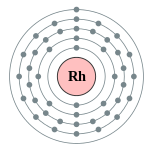
铑 45 金屬:銀白色 名稱·符號 ·序數 铑(Rhodium)·Rh·45 元素類別 過渡金屬 族 ·週期 ·區 9 ·5 ·d 標準原子質量 102.90549(2)[ 1] 电子排布 [Kr ] 4d8 5s1 铑的电子層(2, 8, 18, 16, 1) 發現 威廉·海德·渥拉斯顿 (1804年)分離 威廉·海德·渥拉斯頓 物態 固體 密度 (接近室温 )g ·cm −3 熔点 時液體密度10.7 g·cm−3 熔点 2237 K ,1964 °C ,3567 °F 沸點 3968 K ,3695 °C ,6683 °F 熔化热 26.59 kJ·mol−1 汽化热 494 kJ·mol−1 比熱容 24.98 J·mol−1 ·K−1 蒸氣壓
壓/Pa
1
10
100
1 k
10 k
100 k
溫/K
2288
2496
2749
3063
3405
3997
氧化态 6, 5, 4, 3 , 2, 1[ 2] 电负性 2.28(鲍林标度) 电离能 第一:719.7 kJ·mol−1 −1 −1 原子半径 134 pm 共价半径 142±7 pm 晶体结构 面心立方晶格
磁序 順磁性 [ 3] 電阻率 (0 °C)43.3×10-9 Ω·m 熱導率 150 W·m−1 ·K−1 膨脹係數 (25 °C)8.2 µm·m−1 ·K−1 聲速 (細棒)(20 °C)4700 m·s−1 杨氏模量 380 GPa 剪切模量 150 GPa 体积模量 275 GPa 泊松比 0.26 莫氏硬度 6.0 維氏硬度 1246 MPa 布氏硬度 1100 MPa CAS号 7440-16-6 主条目:铑的同位素
銠 ( lǎo ) Rhodium ;舊譯錴 ),是一種化學元素 ,其化學符號 为Rh ,原子序數 为45,原子量 為7002102905490000000♠ 102.90549 u 惰性 過渡金屬 元素。銠是一種惰性金屬 ,同時是鉑系元素 的一員,為最為稀有和貴重的貴金屬 之一。銠在自然界中只存在一種同位素 103 Rh。自然界中的銠通常以金屬態的形式與性質相近的金屬元素形成合金 ,偶以硫銥鉑銠礦 硫銠鉛礦
銠常和其他鉑系元素 一起在鉑礦石或鎳 礦石中被發現。它首先由英國化學家威廉·海德·渥拉斯頓 於1803年發現,並以它的一種氯 化合物的玫瑰色命名。
大約80%的生產出來的銠元素用於汽車的三向觸媒轉化器 的觸媒。由於其對腐蝕和大部分高反應性化學物質的抗性,同時又因其極為稀有,銠常與鉑 或鈀 組成合金並應用於抗高溫及腐蝕的塗層。白金 上常基於外觀上的考量而鍍有薄層的銠;英幣標準銀 矽氧聚合物 的交聯 催化劑,使帶有氫負離子 的矽氧聚合物和帶有末端乙烯基 的矽氧聚合物混合後發生固化 。[ 4]
銠可製成偵測核子反應爐 的中子流量 醋酸 和農藥年年春 的生產製程上。
威廉·海德·渥拉斯顿 在威廉·海德·渥拉斯顿 发现钯之后[ 5] [ 6] [ 7] 发现 了。他使用了可能从南美洲 获得的粗铂 矿石。[ 8] 王水 中,然后用 氢氧化钠 (NaOH) 中和酸。然后加入氯化铵 (NH ),使铂沉淀为 氯铂酸铵 。大多数其他金属如铜 、铅 、钯 和铑会与锌 一起沉淀。稀硝酸 会溶解除钯和铑之外的所有物质。其中,钯可溶于王水,但铑不溶,[ 9] 氯化钠 ,以 Nan H 的形式沉淀铑。用乙醇洗涤后,玫瑰色的沉淀物与锌发生置换反应 ,置换掉离子化合物中的铑,从而释放游离金属铑。[ 10]
铑被发现后,这种稀有元素只有很少的应用;例如,含铑的热电偶被用于测量高达 1800°C 的温度。[ 11] [ 12] [ 13]
铑的第一个主要应用是用于装饰用途和作为耐腐蚀涂层的电镀。[ 14] 沃尔沃 于1976年推出的三元催化转换器 增加了对铑的需求。以前的催化转化器使用的是铂或钯,而三元催化转换器使用铑来减少废气中NOx 的含量。[ 15] [ 16] [ 17]
銠是一種堅硬耐用的金屬,具有很高的反射率 ,擁有比鉑 更高的熔點 和更低的密度 。多數的酸 無法侵蝕銠,其不溶於硝酸 而微溶於王水 ,但高温下的浓硫酸 会腐蚀金属铑。此外,熔融的焦硫酸盐或过硫酸盐也会溶解铑。
即使處於加熱狀態,銠也難以形成氧化物 [ 18] 熔點 時吸收大氣中的氧,然而一旦固化就又將氧釋出[ 19]
铑的氧化态
+0
Rh
+1
RhCl(PH
+2
Rh
+3 RhCl
+4
RhF
+5
RhF
+6
RhF
銠隸屬於9族元素 ,然而其最外層電子組態 卻有異於同族的其他元素。這個不規則的現象也可在鄰近的鈮 (41)、釕 (44)、鈀 (46)等元素身上觀察到。
銠最常見的氧化態 為+3,但0~+6的氧化態皆有被發現[ 20]
和釕 、鋨 元素不同,銠並不與氧形成具揮發性的化合物。目前已知的穩定氧化物包括:Rh RhO RhOx H 、Na 、Sr 以及Sr [ 21] 鹵素 形成化合物,例如:三氯化銠 、四氟化銠、五氟化銠以及六氟化銠等,其中最廣為人知的就是威爾金森催化劑 ,即氯化三(三苯基膦)合銠(I)。這種催化劑主要用於氫甲醯化反應 以及烯烴 的氫化 反應[ 22]
低價態的銠必須在存在配體 的情況下才能穩定存在[ 23]
自然界中铑以103 Rh同位素 的形式存在。较稳定的放射性同位素 包括101 Rh(半衰期 3.3年)、102 Rh(半衰期207天)、102m Rh(半衰期2.9年)以及99 Rh(半衰期16.1天)。目前已发现20多个放射性同位素,同位素质量从92.926u (93 Rh)至116.925u (117 Rh)。这些同位素的半衰期大部分都在一小时以内,除了100 Rh(半衰期20.8小时)和105 Rh(半衰期35.36小时)。[ 24]
对于原子量小于103的铑同位素,它们主要通过电子捕获 衰变成钌 ;而对于原子量大于103的铑同位素则会β衰变 成钯 。[ 25]
铑是地球的地壳中最稀有的元素之一 ,丰度约为 0.0002 ppm (2 × 10−10 )。[ 26] 陨石 的丰度通常为 1 ppb 。[ 27] 马铃薯 中的铑含量在 0.8 到 30 ppt 之间。[ 28]
銠為鉑 礦中的稀少成分,產量純粹取決有多少鉑礦開採出來,開採的鉑礦越多,從中得到的銠雜質也越多。若市場需求大於供給銠的價格就會高漲,因只為增加銠供給而採更多的鉑礦不符合經濟效益。[ 29]
铑是铀-235 的裂变产物:裂变产物都含有大量较轻的铂族金属。因此,乏核燃料 是铑的潜在来源,但它的提取复杂且昂贵,并且铑放射性同位素的存在需要一段时间的冷却储存,以维持寿命最长的同位素的多个半衰期(101 Rh的半衰期 为 3.3 年,而102m Rh的半衰期 为 2.9年),或大约10年。这些因素使得这个来源完全没有吸引力,也没有尝试大规模提取。[ 30] [ 31] [ 32]
铑的主要用途是在汽车中作为催化转换器 ,将有害的未燃烧碳氢化合物、一氧化碳和氮氧化物废气转化为毒性较低的气体。在2012 年全球消耗的 30,000公斤铑中,81%(24,300公斤)的铑就用于此应用,并且从旧转换器中回收了 8,060公斤铑。大约有964 公斤的铑用于玻璃工业,主要用于生产玻璃纤维和平板玻璃,还有2,520 公斤的铑用于化学工业。[ 33]
铑在催化氮氧化物 分解成氮气 和氧气 时优于其他铂族元素:[ 34]
2 NOx → x O + N
铑催化剂 用于许多工业过程,尤其是通过蒙山都法 ,把甲醇 催化羰基化成乙酸 。[ 35] 双键 的加成,这一过程在某些硅胶的制造中很重要。[ 36] 苯 还原成环己烷 。[ 37]
铑离子和BINAP 的配合物广泛用于手性合成 ,用于合成薄荷醇 。[ 38]
铑可用于珠宝 和装饰品。它在白色黄金 和铂上进行电镀 ,在销售时赋予其反光的白色表面,之后薄层会随着使用而磨损。它也可用于涂层纹银 ,以防止锈蚀(硫化银 Ag2 S,由大气中的硫化氢 H2 S 产生)。纯铑首饰非常稀有,其中的原因更多是因为制作难度大(熔点高,延展性差),而不是价格问题。[ 39] 电镀 。当银、金或铂等更常用的金属被认为不够用时,铑也用于荣誉或象征精英地位。1979年,《吉尼斯世界纪录 》送给保罗·麦卡特尼 一张镀铑唱片,以表彰他是历史上最畅销的词曲作者和唱片艺术家。[ 40]
铑可用来制造合金,用于硬化和提高铂 和钯 的耐腐蚀性[ 18] 热电偶 元件、飞机火花塞 的电极 和实验室坩埚。[ 41]
因为铑的小电阻 、小而稳定的接触电阻 腐蚀 的抵御,它用于制造电触点 。[ 42]
通过电镀 或蒸发镀成的铑非常坚硬,可用于光学仪器。[ 43]
在乳房摄影术 中过滤X光。[ 44]
在核反应 中用含铑的探测仪 测量中子通量 水平。这种方法需要一个数字滤波器来确定当前的中子通量水平,产生三个独立的信号:立即、几秒延迟和一分钟延迟,每个信号都有自己的信号水平。这三个信号都组合在铑检测器信号中。三个帕洛佛得核电站 [ 45] 在汽车制造中,铑还用于制造大灯反射器。[ 46]
78g的铑样本
金属芯催化转换器的剖视图
镀铑的白色黄金婚戒
铑箔和铑丝
作为一种贵金属 ,纯铑是惰性且无害的。[ 48] RhCl ),大鼠的半数致死量 (LD50 ) 为 198 mg/kg。[ 49]
人们可以通过吸入在工作场所接触到铑。职业安全与健康管理局 允许暴露极限 3 (8小时工作日),而美国国家职业安全卫生研究所 (NIOSH) 则把推荐接触限值 3 的浓度下,铑就达到了立刻对生命和健康造成危险值 [ 50] 3 。[ 51]
^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report) . Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075 doi:10.1515/pac-2019-0603 (英语) . ^ Rhodium: rhodium(I) fluoride compound data . OpenMOPAC.net. [2007-12-10 ] . (原始内容 存档于2009-08-06). ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆 的存檔 ,存档日期2011-03-03., in Handbook of Chemistry and Physics 81st edition, CRC press. ^ Armin Fehn and Juergen Weidinger, Wacker Chemie AG, US patent US7129309B2
^ Griffith, W. P. Rhodium and Palladium – Events Surrounding Its Discovery . Platinum Metals Review. 2003, 47 (4): 175–183 [2021-09-02 ] . (原始内容存档 于2013-07-04). ^ Wollaston, W. H. On the Discovery of Palladium; With Observations on Other Substances Found with Platina. Philosophical Transactions of the Royal Society of London . 1805, 95 : 316–330. doi:10.1098/rstl.1805.0024 ^ Usselman, Melvyn. The Wollaston/Chenevix controversy over the elemental nature of palladium: A curious episode in the history of chemistry. Annals of Science. 1978, 35 (6): 551–579. doi:10.1080/00033797800200431 ^ Lide, David R. CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data 4–26 . ISBN 978-0-8493-0485-9 ^ Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements . 2016: 1113. ISBN 978-0-7506-3365-9OCLC 1040112384 (英语) . ^ Griffith, W. P. Bicentenary of Four Platinum Group Metals: Osmium and iridium – events surrounding their discoveries. Platinum Metals Review. 2003, 47 (4): 175–183. ^ Hulett, G. A.; Berger, H. W. Volatilization of Platinum . Journal of the American Chemical Society. 1904, 26 (11): 1512–1515 [2021-09-02 ] . doi:10.1021/ja02001a012 存档 于2022-01-15). ^ Measurement, ASTM Committee E.2.0. on Temperature. Platinum Type . Manual on the use of thermocouples in temperature measurement. ASTM International. 1993. Bibcode:1981mutt.book.....B ISBN 978-0-8031-1466-1 [失效連結 ^ J.V. Pearce, F. Edler, C.J. Elliott, A. Greenen, P.M. Harris, C.G. Izquierdo, Y.G. Kim, M.J. Martin, I.M. Smith, D. Tucker and R.I. Veitcheva, A systematic investigation of the thermoelectric stability of Pt-Rh thermocouples between 1300 °C and 1500 °C, METROLOGIA, 2018, Volume: 55 Issue: 4 Pages: 558-567
^ Kushner, Joseph B. Modern rhodium plating. Metals and Alloys. 1940, 11 : 137–140. ^ Amatayakul, W.; Ramnäs, Olle. Life cycle assessment of a catalytic converter for passenger cars. Journal of Cleaner Production. 2001, 9 (5): 395. doi:10.1016/S0959-6526(00)00082-2 ^ Heck, R.; Farrauto, Robert J. Automobile exhaust catalysts. Applied Catalysis A: General. 2001, 221 (1–2): 443–457. doi:10.1016/S0926-860X(01)00818-3 ^ Heck, R.; Gulati, Suresh; Farrauto, Robert J. The application of monoliths for gas phase catalytic reactions. Chemical Engineering Journal. 2001, 82 (1–3): 149–156. doi:10.1016/S1385-8947(00)00365-X ^ 18.0 18.1 Cramer, Stephen D.; Covino, Jr., Bernard S. (编). ASM handbook . Materials Park, OH: ASM International. 1990: 393–396. ISBN 978-0-87170-707-9 ^ Emsley, John. Nature's Building Blocks (Hardcover, First Edition). Oxford University Press . 2001: 363. ISBN 978-0-19-850340-8 ^ Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils. Lehrbuch der Anorganischen Chemie 91–100. Walter de Gruyter. 1985: 1056–1057. ISBN 978-3-11-007511-3 ^ Reisner, B. A.; Stacy, A. M. Sr (A = Li, Na): Crystallization of a Rhodium(V) Oxide from Molten Hydroxide. Journal of the American Chemical Society. 1998, 120 (37): 9682–9989. doi:10.1021/ja974231q ^ Osborn, J. A.; Jardine, F. H.; Young, J. F.; Wilkinson, G. The Preparation and Properties of Tris(triphenylphosphine)halogenorhodium(I) and Some Reactions Thereof Including Catalytic Homogeneous Hydrogenation of Olefins and Acetylenes and Their Derivatives. Journal of the Chemical Society A . 1966: 1711–1732. doi:10.1039/J19660001711 ^ Griffith, W. P. The Rarer Platinum Metals , John Wiley and Sons: New York, 1976, p. 313.
^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik , The NUBASE evaluation of nuclear and decay properties , Nuclear Physics A, 2003, 729 : 3–128 [2019-07-04 ] , Bibcode:2003NuPhA.729....3A doi:10.1016/j.nuclphysa.2003.11.001 存档 于2015-04-02) ^ David R. Lide (ed.), Norman E. Holden in CRC Handbook of Chemistry and Physics, 85th Edition CRC Press. Boca Raton, Florida (2005). Section 11, Table of the Isotopes.
^ Barbalace, Kenneth, "Table of Elements [失效連結
^ D.E.Ryan, J.Holzbecher and R.R.Brooks, Chemical Geology, Volume 85, Issues 3–4, 30 July 1990, Pages 295-303
^ Orecchio and Amorello, Foods, 2019, volume 8, issue 2, doi : 10.3390/foods8020059
^ 看得到的化學,Theodore Gray著,大是文化 ISBN 978-986652667-1
^ Kolarik, Zdenek; Renard, Edouard V. Potential Applications of Fission Platinoids in Industry (PDF) . Platinum Metals Review. 2005, 49 (2): 79 [2021-09-02 ] . doi:10.1595/147106705X35263 存档 (PDF) 于2015-09-24). ^ Kolarik, Zdenek; Renard, Edouard V. Recovery of Value Fission Platinoids from Spent Nuclear Fuel. Part I PART I: General Considerations and Basic Chemistry (PDF) . Platinum Metals Review. 2003, 47 (2): 74–87 [2021-09-02 ] . (原始内容存档 (PDF) 于2015-09-24). ^ Kolarik, Zdenek; Renard, Edouard V. Recovery of Value Fission Platinoids from Spent Nuclear Fuel. Part II: Separation Process (PDF) . Platinum Metals Review. 2003, 47 (2): 123–131 [2021-09-02 ] . (原始内容存档 (PDF) 于2015-09-24). ^ Loferski, Patricia J. Commodity Report: Platinum-Group Metals (PDF) . United States Geological Survey. 2013 [2012-07-16 ] . (原始内容存档 (PDF) 于2019-01-10). ^ Shelef, M.; Graham, G. W. Why Rhodium in Automotive Three-Way Catalysts?. Catalysis Reviews. 1994, 36 (3): 433–457. doi:10.1080/01614949408009468 ^ Roth, James F. Rhodium Catalysed Carbonylation of Methanol (PDF) . Platinum Metals Review. 1975, 19 (1 January): 12–14 [2021-09-02 ] . (原始内容存档 (PDF) 于2015-09-24). ^ Heidingsfeldova, M. & Capka, M. Rhodium complexes as catalysts for hydrosilylation crosslinking of silicone rubber. Journal of Applied Polymer Science. 2003, 30 (5): 1837. doi:10.1002/app.1985.070300505 ^ Halligudi, S. B.; et al. Hydrogenation of benzene to cyclohexane catalyzed by rhodium(I) complex supported on montmorillonite clay . Reaction Kinetics and Catalysis Letters. 1992, 48 (2): 547. Bibcode:1992RKCL...48..505T S2CID 97802315 doi:10.1007/BF02162706 ^ Akutagawa, S. Asymmetric synthesis by metal BINAP catalysts. Applied Catalysis A: General. 1995, 128 (2): 171. doi:10.1016/0926-860X(95)00097-6 ^ Fischer, Torkel; Fregert, S.; Gruvberger, B.; Rystedt, I. Contact sensitivity to nickel in white gold. Contact Dermatitis. 1984, 10 (1): 23–24. PMID 6705515 S2CID 46626556 doi:10.1111/j.1600-0536.1984.tb00056.x ^ Hit & Run: Ring the changes . The Independent (London). 2008-12-02 [2009-06-06 ] . (原始内容存档 于2009-07-20). ^ Lide, David R. CRC handbook of chemistry and physics 2004–2005: a ready-reference book of chemical and physical data 85th. Boca Raton: CRC Press. 2004: 4–26 [2021-09-02 ] . ISBN 978-0-8493-0485-9存档 于2021-10-09). ^ Weisberg, Alfred M. Rhodium plating. Metal Finishing. 1999, 97 (1): 296–299. doi:10.1016/S0026-0576(00)83088-3 ^ Smith, Warren J. Reflectors . Modern optical engineering: the design of optical systems. McGraw-Hill. 2007: 247–248 [2021-09-02 ] . ISBN 978-0-07-147687-4存档 于2021-10-17). ^ McDonagh, C P; et al. Optimum x-ray spectra for mammography: choice of K-edge filters for tungsten anode tubes. Phys. Med. Biol. 1984, 29 (3): 249–52. Bibcode:1984PMB....29..249M PMID 6709704 doi:10.1088/0031-9155/29/3/004 ^ Sokolov, A. P.; Pochivalin, G. P.; Shipovskikh, Yu. M.; Garusov, Yu. V.; Chernikov, O. G.; Shevchenko, V. G. Rhodium self-powered detector for monitoring neutron fluence, energy production, and isotopic composition of fuel. Atomic Energy. 1993, 74 (5): 365–367. S2CID 96175609 doi:10.1007/BF00844622 ^ Stwertka, Albert. A Guide to the Elements , Oxford University Press, 1996, p. 125. ISBN 0-19-508083-1
^ MSDS - 357340 . www.sigmaaldrich.com. [2022-03-07 ] . (原始内容存档 于2020-11-01). ^ Leikin, Jerrold B.; Paloucek Frank P. Poisoning and Toxicology Handbook . Informa Health Care. 2008: 846 [2021-09-02 ] . ISBN 978-1-4200-4479-9存档 于2021-10-14). ^ Landolt, Robert R.; Berk Harold W.; Russell, Henry T. Studies on the toxicity of rhodium trichloride in rats and rabbits. Toxicology and Applied Pharmacology . 1972, 21 (4): 589–590. PMID 5047055 doi:10.1016/0041-008X(72)90016-6 ^ CDC - NIOSH Pocket Guide to Chemical Hazards - Rhodium (metal fume and insoluble compounds, as Rh) . www.cdc.gov. [2015-11-21 ] . (原始内容存档 于2022-03-02). ^ CDC - NIOSH Pocket Guide to Chemical Hazards - Rhodium (soluble compounds, as Rh) . www.cdc.gov. [2015-11-21 ] . (原始内容存档 于2022-01-27).
釔 Y 原子序:39
锆 Zr 原子序:40
鈮 Nb 原子序:41
钼 Mo 原子序:42
锝 Tc 原子序:43
钌 Ru 原子序:44
铑 Rh 原子序:45
钯 Pd 原子序:46
銀 Ag 原子序:47
镉 Cd 原子序:48