|
СріблоСрі́бло́, арґе́нтум[2] (хімічний знак — , лат. argentum) — хімічний елемент з атомним номером 47, що належить до 11-ї групи, 5-го періоду періодичної системи хімічних елементів. М'який, білий, блискучий перехідний метал, що демонструє найвищу електропровідність, теплопровідність і відбивну здатність у порівнянні з будь-яким металом. Метал міститься в земній корі в чистому, вільному елементарному вигляді («самородне срібло»), як сплав із золотом та іншими металами, а також у таких мінералах, як аргентит і хлораргірит. Більшість срібла виробляється як побічний продукт переробки міді, золота, свинцю та цинку. Срібло здавна цінували як дорогоцінний метал. Срібний метал використовують у багатьох інвестиційних монетах, іноді поряд із золотом.[3] Хоча срібла є більше, ніж золота, його набагато менше як самородного металу. Його чистота, як правило, вимірюється у проміле; 94%-чистий сплав описується як «0,940 тонкодисперсний». Як один із семи металів античності, срібло відіграло стійку роль у більшості людських культур. Окрім валюти й інвестиційних матеріалів (монети та злитки), срібло використовують у сонячних батареях, фільтрації води, ювелірних виробах, прикрасах, високоцінному посуді, в електричних контактах та провідниках, у спеціалізованих дзеркалах, віконних покриттях, при каталізі хімічних реакцій, як барвник у вітражах і в спеціалізованих кондитерських виробах. Його сполуки використовують у фото- та рентгенівській плівці. Розведені розчини нітрату срібла та інших сполук срібла використовують як дезінфікуючі засоби та мікробіоциди (олігодинамічний ефект), додають до пов'язок і перев'язувальних матеріалів, катетерів та інших медичних виробів. ЕтимологіяЛатинська назва argentum походить від пра-і.є. *arǵ- («ясний»). В елліністичному Єгипті, можливо і раніше, срібло часто називали місяцем і позначали знаком місяця (переважно — зростаючим після молодика). Серед алхіміків ця назва срібла також була дуже поширеною. Українська назва срібло (заст. серебро[4], д.-рус. сьребро, срѣбро, сребро) походить від прасл. *sьrebro (південні діалекти праслов'ян), *serbro (північно-західні діалекти). Походження слова остаточно не з'ясоване;[5] найчастіше пояснюється як індоєвропейська діалектна (на відміну від поширенішої *arǵ-) і міграційна назва (вандерворт), споріднена з лит. sidãbras, латис. sudrabs, гот. silubr, давн.в-нім. silbar, англ. і швед. silver, нім. Silber. Тлумачать її як давнє слов'яно-балто-германське запозичення з якоїсь східної мови[5]. У деяких мовах назва срібла водночас означає «гроші», наприклад фр. argent. Від слова argentum походить назва країни Аргентина. Історія Срібло відоме людству з найдавніших часів, але значно пізніше ніж золото, через те що в чистому вигляді зустрічається в природі дуже рідко. Грецькі хроніки приписують відкриття срібла греку Еаку близько 1300 до н. е. Срібло, так само як і золото, часто зустрічалося в самородному вигляді — його не доводилося виплавляти з руд. Це визначило досить значну роль срібла в культурних традиціях різних народів. В Ассирії й Вавилоні срібло вважалося священним металом і було символом Місяця. У Середні віки срібло і його сполуки були дуже поширені серед алхіміків. Із середини XIII ст. срібло стає звичним матеріалом для виготовлення посуду. Срібло й донині використовують для карбування монет. Перу та Мексика добувають срібло з 1546 року й станом на початок XXI століття, залишаються основними світовими його постачальниками. Загальна характеристикаСрібло поряд з золотом і міддю належить до перших металів цивілізації. Срібло є малоактивним металом, внаслідок хімічної стійкості його відносять до благородних металів. Чисте срібло білого кольору. Срібло є одним з основних матеріалів для виготовлення дорогоцінних виробів. За своїми властивостями срібло близьке до золота та міді. Срібло, як і золото, має високу ковкість (найкращу ковкість має золото), м'якісь, тягучість і гнучкість, легко полірується, а у відполірованому вигляді має найвищу відбивальну здатність стосовно білого світла. Срібло можна прокувати в пластинки завтовшки 0,00025 мм. Срібло не взаємодіє з киснем повітря, водою, вуглецем, розчинами лугів, з солями, розбавленою сірчаною кислотою, стійке проти корозії. Розплавлене срібло не змішується з розплавленим залізом і розділяється на два шари, як масло і вода. За звичайних умов реагує з галогенами (утворюючи відносно стійкі солі, які розкладаються при нагріванні чи під дією реагентів), при нагріванні взаємодіє з сіркою (див. Чернь (ювелірна)). Срібло розчиняється лише в таких кислотах, які є сильними окисниками (азотна кислота, гаряча концентрована сірчана кислота та інше). У власних сполуках срібло, як правило, одновалентне. При дії лугів на солі срібла, утворюється гідроксид срібла, який легко відщеплює воду, даючи оксид срібла Ag2O. Велике практичне значення мають галоїдні сполуки срібла. Під дією світла вони розпадаються, виділяючи металеве срібло; на цьому явищі ґрунтується фотографічний процес. При дії амоніаку на нерозчинні солі срібла утворюються розчинні у воді комплексні сполуки. Усі речовини на Землі, крім вісмуту й срібла, коли замерзають, стискуються (вода навпаки — розширюється).[6] Фізичні та хімічні властивості срібла пояснюються його електронною структурою із повністю заповненою d-оболонкою і єдиним електроном на s-оболонці. Завдяки цьому єдиному електрону срібло одновалентне, в металі цей електрон легко відривається від іонного кора атома й колективізується, утворюючи електронний газ. Порівняно з іншими металами, срібло відзначається найвищою електро- і теплопровідністю. Срібло діамагнітне, його магнітна сприйнятливість (0,181•10−9) не залежить від температури; коефіцієнт Холла — 0,9•1010. Срібло має високу відбивну здатність: в ІЧ діапазоні ступінь відбиття променів — 98 %, у видимій частині спектра — 95 %. Межа текучості срібла 10—50 МПа; твердість за Брінеллем 245—250 МПа, за Віккерсом 148—154 МПа; модуль пружності 82,7 ГПа, модуль зсуву 30,3 ГПа. Його питома вага 10,5 г/см3, температура плавлення становить 960,5-962 °C, а густина становить 10,5 г/см3. ІзотопиПриродне срібло складається із двох стабільних ізотопів — 107Ag та 109Ag, з яких 107Ag поширеніший (51,839 %). Відомо 28 радіоактивних ізотопів, найстабільніший із яких 105Ag з періодом напіврозпаду 41,29 днів. У 111Ag період напіврозпаду 7,45, а в 112Ag — 3,13 годин. Усі інші ізотопи живуть менше години, а більшість з них — менше, ніж 3 хвилини. Основним механізмом радіоактивних перетворень для ізотопів, легших від стабільного 107Ag, є захоплення електрона. Внаслідок такого перетворення утворюється паладій. Для важких ізотопів основний механізм радіоактивності — бета-розпад, при якому утворюється кадмій. Сполуки сріблаПри дії лугів на розчини солей срібла утворюється гідроксид срібла (I). Нагрівання гідроксиду понад 60 °C дає оксид срібла: Це порошок бурого кольору, слабко (1:3000) розчинний у воді, причому він надає воді металевий смак і лужність. Під час нагрівання вище 250о окис срібла розкладається на срібло і кисень. При дії на розчини солей срібла сірководню утворюється стійкий сульфід срібла (I): Сірчисте срібло може утворюватися і на поверхні срібних виробів під дією сірководню, що знаходиться в повітрі. Металеве срібло при нагріванні в концентрованій сірчаній кислоті утворює сульфат срібла (I), кристали якого погано розчиняються у воді (при 18 °C — 0,75 %, при 25 °C — 0,82 % і при 100 °C — 1,5 %), нерозчинні у спирті і легко розчиняються у гідроксиді амонію. Діючи на металеве срібло азотною кислотою, отримують нітрат срібла (I) (ляпіс): Азотнокисле срібло дуже добре розчинне у воді (при 20 °C — 68,3 % при 50 °C — 80 % і при 100 °C — 90,1 %) і в спирті (25 %), плавиться при 200 °C і розкладається при 450 °C. Під дією світла або при зіткненні з органічними речовинами, азотнокисле срібло розкладається з виділенням чорного дрібнозернистого металевого срібла. Азотнокисле срібло отруйне. Фторид срібла (I) — AgF·2H2O — прозорі кристали, які розпливаються за звичайної температури і розчиняються у воді в об'ємі 1:1,5. Хлорид срібла (I) AgCl при сплаву з содою розкладається. Утворення хлористого срібла є найякіснішою реакцією на срібло. Бромід срібла (I) AgBr — світлочутливий жовтувато-білий зернистий або пластівчастий осад. Йодид срібла (I) AgJ — ясно-жовтий аморфний порошок, майже нерозчинний у воді, гідраоксиді амонію і розведених кислотах, розчинний у концентрованих розчинах йодиду калію і тіосульфаті натрію (Na2S2O3). При дії на азотнокисле срібло ціаніду калію утворюється білий порошок ціаніду срібла (I): Він не розчинний у воді, але легко розчиняється в надлишку розчину ціаністих солей з утворенням комплексних ціанідів: Аналогічним чином утворюються і інші подвійні ціаніди срібла: Ca[Ag(CN)2]2, Na[Ag(CN)2] і ін. Подібно золоту, металеве срібло у присутності кисню розчиняється в ціаністих солях лужних металів: Цією реакцією користуються при вилученні срібла із руд. При дії на азотнокисле срібло розчину тіоціанату (роданіду) калію утворюється нерозчинний у воді тіоціанат срібла (I): Діючи на розчин азотнокислого срібла в азотній кислоті хроматом або біхроматом калію, отримують дихромат срібла (I) Ag2Cr2O7 — осад блискучого червоного кольору. При кип'ятінні з водою він переходить в хромат срібла (I) Ag2CrO4 — осад червоного кольору, який при охолодженні знову утворює дихромат. При дії на азотнокисле срібло карбонату натрію утворюється карбонат срібла (I) — порошок білого кольору: При кип'ятінні він жовтіє внаслідок часткового розкладання: Вуглекисле срібло малорозчинне у воді, але легко розчиняється в карбонатах лужних металів. А при пропусканні через лужний розчин азотнокислого срібла ацетилену утворюється карбід срібла AgC2, який в сухому стані вибухає. Навіть при легкому розтиранні в ступці. Знаходження в природіЗ благородних металів срібло найширше розповсюджене у природі. У природі зустрічається у вигляді самородного срібла і у вигляді сполук із сіркою, арсеном, стибієм та хлором у таких рудах, як аргентит Ag2S, рогове срібло AgCl та піраргірит Ag3SbS3, кераргітит. Вміст срібла у земній корі (1-7)•10−6% (мас), у морській воді — 1,5•10−8−2,9•10−7 %, прісній — 2,7•10−8 %. Відомо понад 60 срібловмісних мінералів, які розділяють на 6 груп: самородне срібло і його сплави з Cu i Аu; прості сульфіди срібла — акантит і аргентит Ag2S; телуриди і селеніди срібла — гесит Ag2Te, науманіт Ag2Se, евкайрит AgCuSe та ін.; антимоніди і арсеніди срібла — дискразит Ag3Sb та ін.; галогеніди і сульфати срібла — кераргірит AgCl, аргентоярозит AgFe3(SO4)2(ОН)6 і ін.; складні сульфіди або тіосолі, типу nAg2S•mM2S3, де М = As, Sb, Bi, напр., піраргірит Ag3SbS3, прустит Ag3AsS3, полібазит (Ag, Cu)16Sb2S11 і т. ін. Вміст срібла в рудах кольорових металів 10—100 г/т, в золото-срібних рудах 200—1000 г/т, а в рудах срібних родовищ 900—2000 г/т, іноді десятки кілограмів на тонну. Срібло зустрічається і у каустоболітах —торфах, нафті, вугіллі, бітумозних сланцях.[7] Джерела добуткуОсновними джерелами срібла є мідні, мідно-нікелеві, свинцеві та свинцево-цинкові руди. Важливим джерелом добутку є вторинне срібло у вигляді відходів виробів, які відслужили свій термін (в кінофотопромисловості) тощо.[7] Найбільші рудники з видобування срібла у світі: Френсільо у Мексиці, Дукат в Російській Федерації, а також Uchucchacua, Pirquitas і Palmarejo в Перу. Найбільше родовище в США — Greens Creek Mine на Алясці. 2012 року, за даними Геологічної служби США, найбільшими запасами срібла володіло Перу (близько 22 % світових запасів); рудами, що містять срібло, багаті також надра Мексики, Австралії, Чилі, Польщі, КНР та Росії. Всього в значущих обсягах даний метал отримують в 50 країнах світу на всіх континентах.[8]
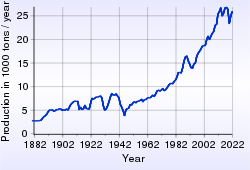 Перша стадія переробки всіх срібловмісних руд — флотаційне та гравітаційне збагачення. Більшу частину С одержують під час переробки сульфідних руд Pb, Zn і Сu, які містять домішки С. При переробці руд кольорових металів отримують близько 70 %, у разі переробки руд золото-срібних родовищ близько 10-15 %, а з руд власне срібних родовищ — 15-20 % світового виробництва цього металу. Найбільші світові виробники срібла (2009 р.): Перу (17,4 % світового виробництва), Мексика (15,3 %), Китай (12,2 %) і Австралія (9,1 %). Крім того, на світовому ринку виділяються Чилі, Польща, Росія, США, Болівія, Канада і Казахстан. За експертними оцінками, світовий видобуток срібла у 2007 р. склав 18,6 тис. тонн. Срібло, так само як і золото, часто зустрічалося в самородному виді — його не доводилося виплавляти з руд. Це визначило досить значну роль срібла в культурних традиціях різних народів. Срібло також можна отримати електролітичним очищенням міді й свинцю, які часто містять його в незначній кількості. Виробництво і споживання срібла у світі[8]
Застосування
Карбування монет. НагородиСрібло давно використовують для додання високого грошового вираження в об'єктах (наприклад, срібних монетах та інвестиційних злитках) або при виготовленні символічних об'єктів високого соціального чи політичного рангу. Завдяки своїм інертним властивостям, стійкості до корозії та легкості плавлення, срібло з древніх часів широко використовували для карбування монет. Як монетний матеріал застосовується з початку 6 ст. до н. е. Лідійський цар Крез (561—546 рр. до н. е.) уперше ввів золото і срібло як монетні метали.[9] Спершу, грошові одиниці та їх назви, як правило, були пов'язані з певною вагою благородних металів: наприклад, фунт стерлінгів означав фунт срібла.[10] З часом золото витіснило срібло, але назва лишилася, хоч вона вже означала значно меншу кількість золота, яка за вартістю дорівнювала фунту срібла.[10] У теперішній час ні срібло, ні золото вже не можуть забезпечити потреби ринку в розмінній монеті — металу на ці цілі просто б не вистачило.[11] Життя срібла, яке більш трьох тисячоліть слугувало для карбування монет, підходить до кінця. Крім того, завжди доводиться мати на увазі, що гроші з дорогих матеріалів неминуче виходять із сфери обігу, витісняються монетами із менш цінних матеріалів. Це явище вперше підмічене ще Коперником, пізніше сформульоване англійським фінансистом Т. Грешемом в економічний закон грошового обігу, який відомий під як закон Коперника-Грешема. Тепер срібло, як правило, використовують для ювілейних монет та медалей, якими зазвичай нагороджують спортсменів за друге місце в спортивних змаганнях. Монети й ювелірні вироби виготовляють не з чистого срібла, а із стерлінгового срібла — сплаву срібла з міддю, в якому частка срібла становить 92,5 %. Таке срібло твердіше й не так швидко зношується.
Ювелірні та дорогоцінні виробиГарний вигляд срібла, його здатність добре сприймати полірування, його пластичність і стійкість на повітрі не лише при звичайній температурі, але і при нагріванні; найвища із всіх металів відбивальна властивість відносно білого світла — всі ці властивості срібла обумовили його широке використання у виготовленні ювелірних виробів, посуду і столових приборів, декоративних елементів. Срібло — м'який метал, який рідко використовують в чистому вигляді;[12] в срібні сплави додавалася мідь. Однак, кількість чистого срібла у виробах варіювалась аж до 1300 року, коли Едуард І встановив систему клеймування англійського срібла, щоб призвести його до загального стандарту.[12] По стандарту срібло повинно було складати в сплаві 92,5 % (7,5 % відводилось міді), щоб офіційно називатися «стерлінговим» і мати право на клеймо з головою леопарда.[12] Стерлінгові срібні ювелірні вироби часто покривають тонким шаром 999 чистого срібла, щоб надати товарам глянцевого покриття. Золото і срібло дуже м'які, і їх можна витягнути в дуже тонку нитку.[13] Цю властивість було підмічено дуже давно і широко використовували її в ювелірній справі. Технічний спосіб з плетіння цих ниток — гладкого проводу різної товщини, з проводу, розплющеного у вигляді стрічки, із сплетених в шнурочки двох або трьох металевих ниток, отримав назву «скань» (старослов'янське) або філігрань, а прикрашені напаяними на металевий фон візерунки з гладеньких кульок срібла — «зернню».[13] Срібло і сплави на його основі як і раніше, відіграють важливу роль в ювелірних виробах.
Антимікробна діяПротимікробні властивості срібла, експериментально підтверджені ще у ХІХ сторіччі, на сьогодні широко застосовують у багатьох галузях життєзабезпечення людини.[14] Антимікробна дія срібла знайшла широке застосування в медицині. Гіппократ, батько сучасної медицини, писав, що срібло має цілющі властивості при лікуванні захворювань та їхньому запобіганні. Фінікійці зберігали воду, вино й оцет у срібних бутлях, щоб запобігти псуванню. На початку 1900-х років люди клали в пляшки з молоком срібні монети з метою зберегти свіжість. Бактерицидні властивості срібла збільшують цінність срібного посуду й біжутерії. Причина бактеріоцидних властивостей срібла досі незрозуміла, хоча існують певні теорії. У срібла бактерицидні властивості виражені набагато більше, ніж у карболової кислоти, сулеми, хлору, хлорного вапна, антибіотиків.[15] Золото підсилює бактерицидну дію срібла.[15] Сполуки срібла використовували для запобігання інфекціям у Першій світовій війні, коли антибіотики ще не були відомі. Стандартно вживався розчин нітрату срібла (ляпісу), на заміну якому прийшла сульфадіазинова мазь. Останніми роками випробовують бинти зі срібними волокнами, хоча ефективність такого засобу ще остаточно не доведена. З відкриттям антибіотиків і сульфаніламідів інтерес до препаратів срібла дещо знизився.[14] Срібло володіє бактерицидною, антисептичною, протизапальною, в'яжучою дією; є природним бактерицидним металом, який ефективний проти 650 видів бактерій, які не набувають до нього стійкості, на відміну від практично усіх антибіотиків.[15] Сполуки срібла застосовуються в фармацевтиці: нітрат срібла, протаргол (Protargolum), колларгол (Collargolum), сульфадіазин срібла (сульфаніламідні препарати).[16][17] КонсервантЦей метал як консервант використовують у технологічних процесах виробництва харчів і напоїв. Розчини срібла, отримані електрохімічним шляхом, є дуже ефективними і надійними консервантами питної води та знезаражувальними агентами.[18][19] Очищення води. Іони срібла у водному розчиніСрібло використовують в очищувачах води. Це запобігає розмноженню бактерій і водоростей в фільтрах. Каталітична дія срібла, спільно з киснем, дезінфікує воду і усуває необхідність хлору. Іони срібла, також додаються в системи очищення води в лікарнях, басейнів і спа, витісняючи застосування хлору. У сучасній водопідготовці древнім способом витримки звичайної води в срібних чи посріблених ємностях навряд чи послугуєшся через низьку швидкість розчинення срібла і через неможливість дозування: швидкість розчинення срібла дуже залежить від величини і стану металевої поверхні (зважені дрібні частинки та солі (особливо хлоридів і сульфатів) утворюють важкорозчинну плівку на поверхні аноду), від сольового складу води, температури і багатьох інших факторів.[18] Спосіб розчинення солей срібла теж не дуже придатний, оскільки такі приготування дуже нестійкі — вони легко розкладаються під дією світла, втрачаючи при цьому свої бактерицидні властивості.[18] Найефективнішим способом є електрохімічне окислення, який дає можливість точно дозувати срібло.[18] Прилади, для отримання срібної води називають іонаторами (в Радянській Україні іонатори випускали на Київському експериментальному заводі медичних виробів, Сумському заводі електронних мікроскопів і Мелітопольському компресорному заводі). Вперше у великих масштабах цей метод використовували у 1942 році, під час війни, на будівництві стратегічного шосе в Індії.[18] За систематичного споживання, концентрація срібла в питній воді не повинна перевищувати 0,05 мг/л.[18] А для лікування застосовувати срібну воду можна лише за призначенням лікаря.[18]
Срібло в організмі людиниМасова частка срібла в організмі людини складає 1•10−6% і накопичується в печінці, нирках, кістковій тканині, залозах внутрішньої секреції.[15] За добу людина з їжею приймає в середньому 0,088 мг срібла.[18] Антимікробна дія срібла вивчена доволі повно, механізм його дії на клітину ще не встановлений.[18] Срібло не відіграє відому природну біологічну роль в організмі людини, і можливі наслідки для здоров'я срібла є спірним питанням. Невідомо жодного біологічного процесу в людському тілі, в якому срібло брало б участь. Саме срібло неотруйне, але деякі його сполуки мають токсичну дію, деякі є канцерогенними. Срібло з білками утворює нерозчинні альбуміни.[15] Залежно від концентрації, срібло може пришвидшувати чи вповільнювати біохімічні реакції з участю ферментів, з різною швидкістю пригнічувати ріст пухлинних тканин, сприяти імунітету проти багатьох захворювань.[18] Колоїдне срібло може всмоктуватися в систему кровообігу організму й відкладатися в різних тканинах організму, що призводить до аргірії, — синьо-сірого забарвлення шкіри, очей і слизових оболонок. Хоча захворювання не завдає серйозної шкоди, але спотворює зовнішність, зазвичай назавжди. Легкі форми аргірії іноді приймаються за ціаноз. Помічено, що люди з ознаками аргірії не схильні до інфекційних захворювань.  У стоматологіїСрібло може бути леговане зі ртуттю при кімнатній температурі, щоб зробити амальгами, які широко використовують для зубних пломб. Для приготування зубної амальгами, суміш порошкоподібного срібла та інших металів, таких як олово і золото змішують з ртуттю до отримання жорсткої пасти, яка може бути адаптована до форми порожнини. Зубні амальгами досягають первісної твердості протягом декількох хвилин, і встановлює жорсткість протягом декількох годин. ФотоматеріалиМайже всі з'єднання срібла (Ag (I)) на світлі розкладаються до вільного срібла і при цьому забарвлюються в сірий або чорний колір, що використовують у фотографії.[9] Понад 30 % всього срібла до недавнього часу використовували для фотографій. Однак в останні роки попит на традиційні фотоматеріали зменшився в зв'язку з розвитком цифрової фотографії. Каталітичні властивостіКаталітичні властивості срібла роблять його ідеальним каталізатором в реакціях окиснення, наприклад при виробництві формальдегіду з метанолу. Срібло є на сьогодні, мабуть, єдиним каталізатором, що може перетворювати етилен в оксид етилену, який потім гідролізують в гліколь, що використовують при виробництві поліестеру. У припояхУ техніці срібло часто використовують як важливий складник припійних сплавів. Його додавання в м'які припої в концентраціях до 2 % дозволяє зменшити розчинення срібних покриттів на спаюваних деталях.[20] Існують також тверді припої із вмістом срібла до 72 %.[21] Вони мають відносно високу температуру плавлення і забезпечують міцні з'єднання, через що такі припої часто застосовуються замість зварювання, в тих випадках, де зварювання з тих чи інших причин є неможливим. Припої на основі срібла використовують для паяння вакуумних приладів, керамічних і композиційних матеріалів, з'єднань різнорідних матеріалів, що володіють дуже різними коефіцієнтами теплопровідності. При цьому чим вище вимоги до корозійної стійкості паяного шва, тим з вищим вмістом срібла застосовуються припої.[22][23][24] Сонячна енергіяПо 20 г срібла використовують у кожній кристалічній сонячній фотоелектричній панелі.[25] Срібло також використовують у плазмонних сонячних батареях. Срібло обирають для відбивального покриття концентрованих сонячних електростанцій.[26] Скляні покриттяУ кубку Лікурга (IV століття н. е.), що знаходиться в експозиції Британського музею, в бронзовій оправі встановлено скла, які містять металеві наночастинки срібла і золота, завдяки чому скла набувають червоний колір в прониклому світлі, і зелено-сірий — у відбитому.[27] Срібло (азотнокисле срібло) застосовано для додання лимонно-жовтого кольору склу, яке використовують у старих соборах Європи. У процесі варіння скла з AgNO3 виділяється дрібнодисперсне срібло, яке рівномірно розподілене по склу. У цьому випадку утворюється безбарвне скло, а забарвлення з'являється при наведенні — повторному нагріванні вже готових виробів. За допомогою солей срібла можна наносити золотисто-жовте забарвлення на окремі ділянки скляних виробів. Особливо добре забарвлюються високоякісні свинцеві скла.[28][29] Вікна Прожектори і автомобільні фари Виготовлення дзеркал Телескопічні дзеркала Інші застосуванняСрібло чи його сплави використовують у:
Серед інших продуктів, де застосовують срібло та його іони, — пральні машини (з метою підвищення ефективності прання метал нашаровують на поверхню барабанів пральних машин.[34]), туалетні сидіння, скло з вмістом срібла, входить до складу товарів широкого вжитку, зокрема шкарпеток, білизни, дезодорантів, гребінців, фарб, фільтрів для води та предметів медичного догляду (бинти, пластирі).[14] та інші. Під час виробництва твердих сичужних сирів, визначають масову частку хлористого натрію в сирі методом з азотнокислим сріблом (без попереднього озолення).[35] Срібло в сплавах дорогоцінних металівТермін «дорогоцінні метали» має промислове і торгове значення, а в науці ці метали називаються «благородними металами» внаслідок своєї інертності по відношенню до окислення і дії хімічних реагентів. Сплави золото-срібло являють собою безперервний ряд твердих розчинів цих металів один в одному. Твердість цих сплавів вища, ніж твердість чистих металів, але в порівнянні з іншими сплавами золота вони м'якіші, ковкіші і добре піддаються механічній обробці. Колір сплавів з підвищенням вмісту срібла змінюється від жовтого до білого: до 30 % колір сплаву зеленувато-жовтий, до 50 — жовто-білий, до 60 — майже білий і при 65 % жовтий колір повністю зникає. Сплави золото-срібло-мідь недостатньо вивчені. Частина з них являє собою суміш двох твердих розчинів. Сплави, які містять понад 500 проб золота, мають однорідну структуру. Найбільшою твердістю володіють сплави з рівним вмістом всіх трьох компонентів, а найменшою — які містять велику кількість одного із складових металів. Сплави срібло-мідь, які містять від 6 до 97 % (вагових) міді, утворюють суміш двох твердих розчинів; в інших співвідношеннях срібло і мідь мають обмежену розчинність один в одному, яка змінюється із зміною температури. При збільшенні кількості міді (від 8 до 96 %) в сплавах підвищується їх твердість і збільшується в'язкість. Сплави володіють хорошою пластичністю, але нагріті до температури червоного розжарення сплави, які місять від 40 до 80 % міді, дуже крихкі. Колір сплавів при збільшенні кількості міді змінюється від білого до червонувато-жовтого. Найзастосовуваніші в техніці сплави містять від 500 до 925 проб срібла. Сплави срібло-платина, які містять до 3 % і вище 80 % срібла, утворюють тверді розчини. При вмісті 25, 50 і 75 % (атомних) платини утворюються хімічні з'єднання, відповідно Ag3Pt; AgPt і AgPt3, які під час відпалу при температурі 550оС змінюють склад. Решта сплави утворюють механічні суміші твердих розчинів. Твердість сплавів збільшується з підвищенням вмісту платини від 39,8 кг/мм2 — при 10 % (вагових) платини — до 225,9 кг/мм2 при 80 % платини (при відпалу до 690оС). Відлив сплавів, особливо з великим вмістом срібла, є проблемним внаслідок поглинання ними кисню. Сплави срібло-паладій утворюють безперервний ряд твердих розчинів, володіють високою пластичністю і значною неокислюваністю, але при нагріванні поглинають водень. Сплави золото-паладій-срібло утворюють безперервний ряд твердих розчинів, володіють високою пластичністю і неокислюваністю та мають гарний колір. Сплави паладій-срібло-мідь при великому (понад 50 %) вмісті срібла і міді утворюють механічні суміші, а за великого вмісту паладію — тверді розчини. Висока температура під час обробки, сприяє переходу твердих розчинів в механічні суміші. Сплави срібло-ртуть (амальгами) утворюють тверді розчини з максимальною концентрацією в 55 % (вагових) срібла. Крім того, при вмісті в амальгамі 29-30 % срібла утворюється хімічне з'єднання Ag3Hg4. Ціна До середини II тисячоліття до н. е. срібло було великою рідкістю і цінувалося дорожче за золото.[36] До Доби великих географічних відкриттів срібло цінилося від 1/6 до 1/12 від золота. Відкриття срібних руд в Америці призвело до здешевіння металу. 1980 року ціна срібла досягла максимуму в 49,45 доларів США за унцію через маніпуляції на ринку Нельсона Банкера Ханта і Вільяма Герберта Ханта. У цінах 2012 року це приблизно 138 доларів за унцію. До грудня 2001 року ціна впала до 4,15 долара, а в травні 2006 року знову піднялася до 15,21 долара. У березні 2008 року ціна унції срібла становила 21,34 долара. Наприкінці квітня 2011 року ціна на срібло досягла верхньої межі — 49,76 доларів за унцію. Потім ціна почала опускатися. У середині лютого 2013 срібло коштувало приблизно 31,0 долар за унцію, тобто 1/53 від ціни на золото. Це співвідношення за останнє сторіччя змінювалося від 1/15 до 1/100 в залежності від попиту й пропозиції.[8] Срібло можна купити в банку, брусочки срібла починаються від п'яти грам і до п'яти кілограм. Звичайна кількість відсотків срібного ювелірного виробу має містити 92,5 %, тобто 925 проба. Але в банку кількість відсотків срібного брусочка має вмістити 99,9 %, тобто 999 проба. Офіційні (облікові) курси банківських металів встановлює Національний банк України.
Догляд за виробами зі сріблаВ атмосфері, яка містить навіть незначні кількості сірководню або інші з'єднання сірки, срібло темніє, покриваючись нальотом сірчистого срібла.[31] Темний наліт зі срібних виробів видаляють так:
Зовнішній вигляд срібних виробів можна покращити одним із таких способів:
Після очищення срібні вироби обов'язково слід промити теплою водою і ретельно насухо витерти. Окрім домашніх методів очищення, виділяють також професійні. Їх широко використовують ювеліри, оскільки дають найкращий результат без завдання шкоди прикрасам. До професійних належать:
Див. такожПримітки
Література
Посилання
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||






![{\displaystyle \mathrm {AgCN+KCN{\xrightarrow {}}K[Ag(CN)_{2}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/773bfb7587d4da5262b8fa120db19d1b4bdca204)
![{\displaystyle \mathrm {4Ag+8KCN+O_{2}+2H_{2}O{\xrightarrow {}}4K[Ag(CN)_{2}]+4KOH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7b373f798dd985df65e86b12c65caa2576d49e4a)













