| シアン化カリウム
|

|
|
|
|
| 識別情報
|
| CAS登録番号
|
151-50-8 
|
| EC番号
|
205-792-3
|
| 国連/北米番号
|
1680
|
| RTECS番号
|
TS8750000
|
| 特性
|
| 化学式
|
KCN
|
| モル質量
|
65.12 g/mol
|
| 外観
|
白色結晶
|
| 密度
|
1.52 g/cm3
|
| 融点
|
634 °C, 907 K, 1173 °F
|
| 沸点
|
1625 °C, 1898 K, 2957 °F
|
| 水への溶解度
|
71.6 g/100 ml (25 ℃)
|
| 熱化学
|
標準生成熱 ΔfHo
|
-113.0 kJ mol-1
|
標準モルエントロピー So
|
128.49 J K-1 mol-1
|
標準定圧モル比熱, Cpo
|
66.27 J K-1 mol-1
|
| 危険性
|
| 安全データシート(外部リンク)
|
ICSC 0671
|
| GHSピクトグラム
|
   
|
| GHSシグナルワード
|
危険(DANGER)
|
| EU分類
|
猛毒 (T+)
環境への危険性 (N)
|
| EU Index
|
006-007-00-5
|
| NFPA 704
|
|
| Rフレーズ
|
R26/27/28, R32, R50/53
|
| Sフレーズ
|
(S1/2), S7, S28, S29, S45, S60, S61
|
| 引火点
|
不燃性
|
| 発火点
|
無し
|
| 半数致死量 LD50
|
5 - 10 mg kg (ネズミ、マウス、ウサギ)[1]
|
| 関連する物質
|
| その他の陰イオン
|
シアン酸カリウム
チオシアン酸カリウム
|
| その他の陽イオン
|
シアン化ナトリウム
|
| 関連物質
|
シアン化水素
|
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。
|
シアン化カリウム(シアンかカリウム、英 Potassium cyanide)、青酸カリウム(せいさんカリウム)は、青酸カリ(せいさんカリ)、青化カリ(せいかカリ)とも呼ばれ、毒物の代名詞的存在だが工業的に重要な無機化合物である。毒物及び劇物指定令で「シアン化合物」として毒物に指定されている。
性質
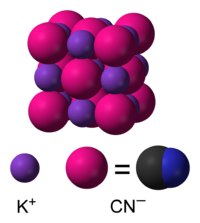
化学式 KCN で表される代表的なシアン化アルカリ化合物。固体はカリウムイオンとシアン化物イオンよりなるイオン結晶である。シアン化物イオン中の炭素と窒素は三重結合を形成している。
白色の粉末状結晶で潮解性があり、水は易溶、メタノール、エタノール、グリセリンに少溶。水溶液は強アルカリ性を示す。溶解度は、文献によっては溶液100g中に溶解する最大質量として41.7g/100g(26℃)という値が見られる。しかし、表は水100gに溶解する最大質量を、出典から挙げている。
乾燥状態では無臭だが、潮解により空気中の二酸化炭素と反応し、シアン化水素を放出しながら炭酸カリウムに変化するため、シアン化水素による特徴的な臭気を発する。特に太陽光に当たる状態では反応が進み易いため、空気に触れないように、太陽光に当たらないように保管する必要がある。

シアン化ナトリウムと同じく、遷移金属と反応して水に可溶なシアノ錯塩を形成する性質をもつ。この反応のため、銀や銅のさび落としに使うことができる。また、銅貨を用いたシアンの簡易検出法の原理でもある。
![{\displaystyle {\ce {{2Ag2S}+ {8KCN}-> {4K[Ag(CN)2]}+ 2K2S}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ecd835c8cb54372ffa218d9edbfeb5d31d22930)
利用分野
シアン化合物はカリウム塩とナトリウム塩が主に利用され、日本の場合、シアン化ナトリウムでは年間約3万トンが生産されている。
- 冶金:青化法(1890年開発)による低品位鉱や廃材からの金、銀類の抽出。細かく砕いた金銀鉱石をシアン化カリウム溶液に投入、鉱石中の金・銀をシアン化カリウムと化合させた後、液体と固体(鉱滓)を分離。金・銀を含む液体に亜鉛粉末を加えて、金・銀を分離沈殿させる。回収した金・銀は冶金され、青金と呼ばれる金・銀の合金の地金として出荷される。ただし、このままでは商品として流通せず、金と銀を分離させる精錬が必要である。
- 鍍金:電解メッキ法のひとつである青化浴は、金、銀、銅、亜鉛、真鍮、カドミウムなどでのメッキに古くから利用されている(シアン化物を使わないジンケート浴、酸性浴への置換が進んでいるが、なお主流)。
- 写真:銀板写真の銀メッキや青写真。現代のフィルム製造や現像にはシアン化物はほとんど使われていない。
- 漁業:川や海にシアン化物を流す「毒物漁法」。当然環境に有害だが、国によっては観賞魚捕獲等に多用されているという。
- 分析試薬:硬度滴定などで、妨害イオンをマスキングするために使用される。
- 合成:樹脂や医薬品、農薬の合成材料や安定剤として需要がある。
- 昆虫標本:バッタなどの標本を作るときに使うと、標本の色が抜けにくくなる。
なお、シアン化カリウム(青酸カリ)はフィクションなども含めて毒物として有名であり、一般的な物質であるかのように思われる傾向があるが、産業的にはシアン化ナトリウム(青酸ソーダ)のほうが利用量が多く、工場などにありふれている。
毒性
- 人体に有害な毒物で、経口致死量は成人の場合200 - 300mg/人と推定されている。全血中のシアン濃度が1.0~2.5μg/mlで意識障害、2.5~3.0μg/mlで昏睡、それ以上では死亡するとされる[2]。体内でチオシアン酸に代謝され、30 - 60mg-CN/hであれば、肝臓で解毒できるとされる。慢性中毒を起こす最小中毒量(TDL0)14mg/kg、許容濃度 5 mg-CN/m3。長期又は反復曝露による甲状腺、腎臓、肝臓、脾臓、中枢神経系の障害のおそれがある(参考: ラット経口 LD50 5 - 10mg/kg)[2]。
- 胃酸により生じたシアン化水素が呼吸によって肺から血液中に入り、重要臓器を細胞内低酸素により壊死させることで個体死に至るとされる。初期症状は頭痛・眩暈・頻呼吸・頻脈であり、重症例では固定散瞳・意識障害・昏睡・痙攣・無呼吸・徐脈・血圧低下・チアノーゼといった中枢神経症状と循環器系症状が早期から出現するとされる[3]。
- 致死量を超えている場合、適切な治療をしなければ15分以内に死亡する。死因は静脈血が明赤色(一酸化炭素中毒と同じ)などから判断できる。これは、シアン化カリウムは水溶液中で電離してカリウムイオンとシアン化物イオンとなるが、このシアン化物イオンは一酸化炭素と同様にヘム鉄に配位結合して酸素との結合を阻害することにより、呼吸による酸素の供給ができなくなるためである[2]
- また、皮膚から吸収することによっても中毒を起こす。さらには細菌以上の動物ミトコンドリアのシトクロム酸化酵素 (COX) 複合体と結合・封鎖し、電子伝達系を阻害することでATP生産量を低下させ細胞死を引き起こすとされる[4]。この点で植物ミトコンドリアはシアン耐性経路であるAOX酵素 (alternative oxidase) を備えるため耐性を持つ。
- 水生生物への毒性が非常に強く、水質の環境基準では検出されないこと(定量限界0.1mg/L未満)、一律排水基準では1mg/Lとされている。分析法としてはJIS K0102に吸光光度法とイオン電極法が規定されているが、いずれも蒸留操作が必須で熟練と操作時間を要する。そのほか、自動分析装置が各社にて開発されている[5]
治療法
塩類の摂取による中毒は、シアン化水素ガスの吸入によるものに対し進行が遅く、救命できる可能性が高い。ただし、口同士が触れる人工呼吸は厳禁である[6]。
拮抗剤としては、亜硝酸アミル、亜硝酸ナトリウム、チオ硫酸ナトリウム(米国ではこれらのキット)があるが、国内では亜硝酸ナトリウムの製品はなく、院内調製となる[2]。亜硝酸はメトヘモグロビンを形成させ、これにCNを結合させることにより、cytochrome oxidaseへの結合と競合させ、チオ硫酸はCNと結合して尿中に排泄可能なチオシアン酸を形成させることにより、CNの排泄を促進させる[2]。
シアン化物#シアン化合物の解毒剤も参照のこと。
廃棄処理
シアン含有廃液の処理法としては、高濃度では電気分解法や燃焼法、中・低濃度ではアルカリ塩素法のほか、オートクレーブによる熱加水分解法、鉄・亜鉛塩による沈殿法(紺青法・亜鉛白法)などがあり、一般的にはアルカリ塩素法が広く用いられる。
- アルカリ塩素法
- 一次反応:水酸化ナトリウムと次亜塩素酸ナトリウムによりpH10-10.5、ORP+300-350mVとし、シアン酸ナトリウムと塩化ナトリウムに分解する。

- 二次反応:塩酸によりpH7.5 - 8.5、ORP+600mV超とし、二酸化炭素、窒素、アンモニウムイオン、塩化ナトリウムに分解する。

- 共存金属イオンによってはシアノ錯体形成により効率が低下する(銅・亜鉛は容易、ニッケル・銀は困難、鉄・コバルト・金は不可)
- 紺青法・亜鉛白法
- 鉄や亜鉛イオンを加え、シアン化物イオンと難溶性のシアノ錯体を形成、沈殿分離させる。薬品・設備ともに安価だが、沈殿したシアノ錯体含有スラッジの処分が問題となる(漏洩防止の緊急処置用としては有効)
- 太陽光分解
- 少量の鉄シアノ錯体溶液などは、ほうろう引きの浅いバットに入れ、数日間直射光に晒すと分解して水酸化鉄になる。塩化鉄溶液を滴下して紺青が生じなければ、分解終了。
その他
摂取して胃酸と反応するとアーモンドまたはオレンジ臭、アンズ臭、梅臭を発するという。ここでいうアーモンド臭とは、収穫前のアーモンドの臭いであるが、遺伝的に半数の人は感知できない[6]。また、シアン化カリウムは、空気より軽く高い揮発性を有するため、効果的濃度以上であれば高い殺傷力を有するが、それ以下では効果がない[6]。
青酸カリによる中毒死体の特徴として、鮮紅色の死斑が見られるほか、主な病変として流動血、肝腎細胞の混濁腫脹、漿膜下の出血斑、粘膜下の充血や出血、肺肝脾腎の鬱血といった共通病変が見られる[7]。
前述の通り、青酸カリは昆虫標本の作製などに用いられ、薬局や文房具店で比較的容易に入手できたため、その威力が分かると青酸カリ自殺が流行した[8]。昭和11年1月10日付けの読売新聞には「昨年十一月浅草の校長毒殺事件が起って以来といふもの猫も杓子も『自殺は青酸加里……』といふことに相場がきまってしまった」と書かれたという。
法規制
シアン化カリウムは様々な法規制下に置かれている。
毒物及び劇物指定令で無機シアン化合物として毒物に指定されており、毒物及び劇物取締法に基づいた購入時の身元確認や販売記録の保管、鍵がかかる倉庫などでの保管や在庫量の記録が求められている[9]。しかし、ずさんな管理による紛失流出が相次いでおり、2006年(平成18年)には、東京大学の研究室で3,000人分の致死量に相当する、青酸カリ500グラム入りのビンが紛失した[10]。
その他、船舶安全法、航空法、海洋汚染等及び海上災害の防止に関する法律(海洋汚染防止法)、大気汚染防止法、水質汚濁防止法、土壌汚染対策法、化学物質の審査及び製造等の規制に関する法律(化審法)、特定化学物質の環境への排出量の把握等及び管理の改善の促進に関する法律(化管法)、労働安全衛生法などの法規制がある[11]。
脚注
- ^ Bernard Martel. Chemical Risk Analysis: A Practical Handbook. Kogan, 2004, page 361. ISBN 1903996651.
- ^ a b c d e “その13 青酸化合物”. 一般社団法人日本中毒学会 (2018年10月3日). 2020年5月10日閲覧。
- ^ 千葉宣孝,木下浩作,佐藤順,蘇我孟群,磯部英二,内ヶ崎西作,丹正勝久「シアン化カリウムによる急性中毒の1救命例」『日本救急医学会雑誌』第24巻第10号、日本救急医学会、2013年、871-876頁、doi:10.3893/jjaam.24.871、ISSN 1883-3772。
- ^ ふたばクリニック コラム「果実に潜むシアン化水素(青酸ガス)」
- ^ 日本産業規格 JISK0102:2019 工場排水試験法
- ^ a b c “生物・化学戦(BC)の対処法(化学) - 血液剤(シアン化合物) | 緊急災害医療支援学 - Disaster Medical Logistics Support Research - |”. www.group-midori.co.jp. 2020年5月10日閲覧。
- ^ 高野義臣,浦郷篤史,金子義郎「急性青酸カリ中毒屍剖検例」『九州歯科学会雑誌』第12巻第1号、1958年、85-88頁、doi:10.2504/kds.12.85、ISSN 0368-6833。
- ^ 槌田満文「青酸カリ事件の思い出」『文藝論叢』第25巻、文教大学女子短期大学部文芸科、1989年、28-29頁。
- ^ “青酸カリ脅迫 管理厳重、入手元は?”. 日本経済新聞 電子版. 2020年5月10日閲覧。
- ^ “青酸カリ脅迫 入手ルート、流出品悪用の可能性”. SankeiBiz(サンケイビズ) (2019年2月19日). 2020年5月10日閲覧。
- ^ “NITE 化学物質総合情報提供システム(NITE-CHRIP)シアン化カリウム”. NITE-CHRIP. 2020年5月10日閲覧。
関連項目
外部リンク








![{\displaystyle {\ce {{2Ag2S}+ {8KCN}-> {4K[Ag(CN)2]}+ 2K2S}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ecd835c8cb54372ffa218d9edbfeb5d31d22930)

