|
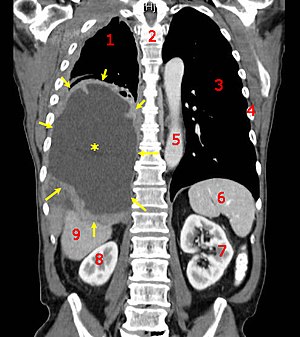
Злоякісна пухлина
Злоя́кісна пухли́на — патологічний процес, зумовлений неконтрольованим розмноженням клітин, інвазією та, іноді, метастазуванням. Залежно від типу тканини, клітини якої перетворились на злоякісні, розрізняють рак, саркому, лімфому та інші види злоякісних пухлин. ХарактеристикаЗагальною характеристикою злоякісних пухлин є їхні виражені тканинні аплазія, атипізм (тобто втрата клітинами здатності до диференціювання із порушенням структури тканини, з якої розвивається пухлина), агресивне зростання з ураженням, як самого органу, так і інших прилеглих органів, схильність до метастазування, тобто до поширення клітин пухлини із током лімфи або крові по всьому організму з утворенням нових вогнищ пухлинного росту (метастазів) в багатьох органах, віддалених від первинної пухлини. За стрімкістю зростання, більшість злоякісних пухлин перевершують доброякісні та, як правило, можуть досягати значних розмірів у короткі терміни. Розрізняють також вид місцево деструктивних злоякісних пухлин, що ростуть з утворенням інфільтрату в товщі тканини, призводячи до її руйнування, але, як правило, не метастазують. До таких форм відносять, наприклад, базаліому шкіри. Існує поверхневий пухлинно-специфічний антиген, поява якого пов'язується не з утворенням раковою клітиною яких-небудь нових білків, а із втратою нею частини поверхневої структури. Перешкодою до розпізнавання лімфоцитами є «слабка антигенність» багатьох спонтанних пухлин. Це може бути викликано дестабілізацією поверхневої мембрани клітин за злоякісного переродження. Антигенні детермінанти виявляються вільно плаваючими у «рідкій» мембрані й не можуть бути впізнаними відповідними лімфоцитами. Основну роль у реакції неприйняття пухлинного трансплантата відіграють специфічні T-кілери, а також (на перших етапах) цитотоксичні антитіла Ig M. Взаємодія між лімфоцитом-кілером й клітиною здійснюється в три етапи:
У цій реакції одна Т-клітина здатна завдати удару по декількох пухлинних клітинах. Foxp3 — транскрипційний чинник, регулюючий активність генів, які є відповідальними за диференціювання Т-клітин[2]. Аспекти взаємодії специфічних імунних сил та злоякісного новоутворення можна з'ясувати при дослідженні простої моделі, яка містить динаміку активних клітин пухлини та лімфоцитів-кілерів . Модель записується у вигляді:
Тут припускається, що клітини пухлини розмножуються зі сталою питомою швидкістю обмеження швидкості росту пухлини відбувається через знищення злоякісних клітин лімфоцитами-кілерами (). Рівняння динаміки лімфоцитів містить член, який описує їх розмноження, У моделі припускається, що за малого пухлина стимулює проліферацію лімфоцитів, а за великого — пригнічує. Два інших члени у другому рівнянні відповідають природній смерті лімфоцитів й сталому притокові попередників із «стовбурових клітин». Смерть лімфоцитів за взаємодії із пухлинними клітинами тут явно не враховується, оскільки припускається, що один лімфоцит може знищити декілька пухлинних клітин. Вважаючи кількість пухлинного антигену пропорційним числу клітин пухлини (), можна записати швидкість виробництва лімфоцитів в залежності від кількості антигену:
де — коефіцієнт розмноження лімфоцитів за максимальної стимуляції (). Константа характеризує антигенність пухлини: за імунна відповідь є послабленою. Можливість ракових клітин функціонувати в умовах низької концентрації глюкози вказує на їх високу спорідненість до неї. Відтак гормони надниркової залози (глюкокортикоїди), які стимулюють процеси глюконеогенезу, в організмі зі злоякісною пухлиною можуть пригнічувати імунні сили організму. Відтак проблемою онкоімунології є розробка ефективних методів імунотерапії злоякісних пухлин. Одним з таких методів є імунотерапія пухлин, заснована на ад'ювантній дії мікроорганізмів — представників різних видів Corynebacterium, Mycobacterium, Streptococcus тощо. Вони посилюють Т-кілерну активність[3]. Розгляньмо математичну модель боротьби за глюкозу. Ракові клітини мають здатність до швидшого перенесення молекул глюкози через мембрану. Це створює перевагу ракових клітин у конкурентній боротьбі з іншими клітинами організму за глюкозу. Пухлина дії як «пастка глюкози» (а також вітамінів, азотистих основ й інших метаболітів), конкуруючи зі здоровими клітинами за життєво важливі ресурси[4]. Вироблення глюкокортикоїдів у організмі пухлиноносця можна розглядати як інактивацію ними лімфоцитів. В умовах глюкозного голодування вироблення цих гормонів зростає; вони пригнічують лімфоїдну систему. Динаміка клітин пухлини та лімфоцитів
Член описує загибель лімфоцитів при взаємодії із глюкокортикоїдами, концентрація яких позначена через У цій моделі припускається залежність питомих швидкостей розмноження клітин від концентрації глюкози як лімітуючого субстрату. При цьому залежить від концентрації глюкози у крові a — від локальної концентрації біля пухлини Локальна концентрація може бути значно нижча від однак вона повинна бути пропорційна їй: Можна припустити, що залежність швидкості репродукції від концентрації субстрату виражається законом Моно:
Константа Міхаеліса для пухлинних клітин є на порядок меншою, ніж для нормальних клітин організму. Для особливо злоякісних (наприклад, асцистна карциноса Ерліха) ця відмінність досягає навіть трьох порядків: г/л проти г/л для клітин печінки. Щоб замкнути модель, можна застосувати рівняння глюкозного балансу у організмі:
Перші два члени описують споживання глюкози пухлиною та лімфоцитами, пропорційні швидкості прирощення їх біомаси ( — питоме споживання). Наступний член — споживання глюкози іншими клітинами організму ( — маса організму, віднесена до об'єму крові — складає близько 7 % для людини, тому г/л). Питоме споживання можна вважати пропорційним концентрації глюкози, оскільки насичення глюкозою відбувається за концентрацій, які перевищують норму принаймні вдвічі. Таким чином,
Потреба організму у глюкозі у нормі складає мг/добу на 1 г маси тіла, або (доба)−1. Загальне споживання усього організму масою 70 кг тоді буде г/(лдобу). Порівняймо це із цифрами швидкості споживання глюкози раковими клітинами карциноми Ерліха у сприятливих умовах (за ) та у реальних умовах (). Маємо, відповідно та Таким чином, навіть реальні швидкості, лімітовані низьким вмістом глюкози в асцитній рідині, майже у 30 разів перевищують питому швидкість споживання нормальної тканини. Надходження глюкози ззовні (із харчами) для зручності можна поділити на два члени: основний (споживаний потребами організму у нормі, та мале прирощення — відхилення від норми у ту чи іншу сторону):
Член представляє синтез глюкози (глюконеогенез), пропорційний концентрації глюкокортикоїдів Та функція описує запасання глікогену за надлишку глюкози у крові та зворотний процес — розщеплення глюкогену із утворенням глюкози за її недостачі[5].
ІсторіяВперше злоякісні пухлини були описані в єгипетському папірусі приблизно в 1600 році до н. е. У папірусі розповідається про кілька форм раку молочної залози і повідомляється, що від цієї хвороби немає лікування. Назва «рак» походить від введеного Гіппократом (460—370 до н. е.) терміна «карцинома» на позначення злоякісної пухлини з перифокальним запаленням. Її форма нагадує зовні краба. Гіппократ описав кілька видів раку, а також запропонував термін oncos. Римський лікар Авл Корнелій Цельс (лат. Aulus Cornelius Celsius) в першому столітті до н. е. запропонував на ранній стадії лікувати рак видаленням пухлини, а на пізніх — не лікувати взагалі. Він переклав грецьке слово carcinos на латину: лат. cancer — рак. Також античний медик Клавдій Гален використовував слово oncos для опису всіх пухлин, що і дало сучасний корінь слову онкологія. В Україні ще 1920 року були засновані Харківський науково-дослідний інститут медичної радіології та Київський рентгено-радіологічний та онкологічний науково-дослідний інститут. Останній опрацював багато питань рентгенології та радіобіології, методики діагностики та комплексного лікування злоякісних пухлин. Щорічно 4 лютого відзначають Всесвітній день боротьби проти раку, встановлений «Міжнародним союзом по боротьбі з онкологічними захворюваннями». Також 15 лютого оголошено Всесвітнім днем онкохворої дитини. Етіологія та патогенезСучасній медицині відома велика кількість факторів, здатних запустити механізми канцерогенезу. Речовини або фактори довкілля, що володіють такою властивістю, називають канцерогенами.
В цілому впливаючи на клітину, канцерогени спричинюють певні порушення її структури і функції (особливо ДНК), що називають ініціацією. Пошкоджена клітина таким чином набуває виражений потенціал до малігнізації. Повторний вплив канцерогену (того ж, що викликав ініціацію, або будь-якого іншого) призводить до незворотних порушень механізмів, які контролюють розподіл, ріст і диференціювання клітин, в результаті яких клітина набуває ряд здібностей, не властивих нормальним клітинам організму — промоція. Зокрема, пухлинні клітини набувають здатності до безконтрольного поділу, втрачають тканиноспецифічну структуру та функціональну активність, змінюють свій антигенний склад тощо. Зростання пухлини (пухлинна прогресія) характеризується поступовим зниженням диференціювання і збільшенням здатності до безконтрольного поділу, а також зміною взаємозв'язку «пухлинна клітина — організм», що призводить до утворення метастаз. Метастазування відбувається переважно лімфогенним шляхом (тобто із током лімфи) в регіонарні лімфатичні вузли, або ж гематогенний шляхом (з током крові) з утворенням метастазів у різних органах (легені, печінка, кістки тощо). Ознаки злоякісних пухлин:
ДіагностикаTNM класифікаціяTNM класифікацію запропонував 1952 року Міжнародний союз проти раку (англ. Union for International Cancer Control (UICC))[7]. Дана класифікація використовує числове позначення різних категорій на позначення поширення пухлини, а також наявності або відсутності локальних та віддалених метастазів. Зазвичай застосовують для клінічної характеристики злоякісних пухлин. Останню редакцію TNM видали в 2017 році. T — tumorВід лат. tumor — пухлина. Описує та класифікує основне розташування пухлини:
N — nodulusВід лат. nodulus — вузлик. Описує і характеризує наявність метастазів суто у лімфатичні вузли:
M — metastasisНаявність метастазів (нових вогнищ пухлини) в інших органах та системах:
P — penetrationГістологічний критерій, який характеризує глибину вростання пухлини в стінку порожнистого органа Р1 — інфільтрує слизову оболонку Р2 — слизову і підслизову Р3 — розповсюджується до субсерозного шару Р4 — інфільтрує серозну оболонку і виходить за межі органа. G — gradusСтупінь злоякісності за рівнем диференціації клітин пухлини G1 — низька (високодиференційовані пухлини) G2 — середня (середньодиференційовані пухлини) G3 — висока (недиференційовані пухлини)[8] Додаткові символиYY — означає підтвердження пухлини на момент обстеження. Цей індекс записують до системи TNM, як префікс: yTNM. R — recidereR з лат. recidere - рецидив, означає рецидив пухлини. АПрефікс «А» вказує на те, що пухлини знайшли після аутопсії. Обов'язкові символиL — lymphatic systemСимвол L вказує на те, що інвазія пухлини є в лімфатичних шляхах:
V — venaV від лат. vena — вена, вказує на інвазії пухлини у венозних судина:
Pn — perineuralPn з лат. perineural — периневральна інвазія пухлини:
C-фактор — certainty factorС-фактор показує наявність пухлини завдяки діагностиці, поділяється на:
Гістологічна класифікаціяМіжнародна Класифікація Онкологічних Захворювань (МКЗ-О) є міжнародним стандартом із питань злоякісних пухлин. З гістологічної точки зору існує понад 100 різновидів злоякісних пухлин, МКЗ-О згрупувало їх в 6 головних категорій[9]:
Поширення пухлиниЗлоякісна пухлина поширюється у тілі в декілька етапів[18]:
Епідеміологічна динамікаЗахворюваність на злоякісні пухлини безперервно зростає. Щорічно у світі реєструється близько 6 мільйонів нових випадків захворювання злоякісними пухлинами. Найвища захворюваність серед чоловіків відзначена у Франції (361 осіб на 100 000 населення), серед жінок — у Бразилії (відповідно 283,4 на 100 000 осіб). Частково це пояснюється старінням населення. Більшість ракових пухлин розвивається в осіб старших за 50 років, а кожен другий онкологічно хворий старший за 60 років. Найчастіше уражаються передміхурова залоза та легені у чоловіків і молочна залоза у жінок. Смертність від онкологічних захворювань у світі посідає друге місце після захворювань серцево-судинної системи. Навіть в економічно успішних європейських країнах щорічно від онкозахворювань помирають 837 тис. осіб і реєструється близько 4 млн нових випадків захворювання. За прогнозами Всесвітньої організації охорони здоров'я, до 2020 року онкохвороби можуть вийти на перше місце, а за даними Американської асоціації госпіталів — це повинно було статися вже 2019 року.[19]  Становище в УкраїніНині кожний 270 українець має діагноз злоякісного новоутворення, кожен 50-тий українець хворів чи хворіє певним онкологічним захворюванням. За останні 10 років кількість хворих збільшилася на 25 % і продовжує зростати на 2,6-3 % на рік, ця тенденція також супроводжується «омолодженням» злоякісних новоутворень. Щороку в Україні виявляють понад 160 тисяч нових випадків злоякісних новоутворень, майже 100 тисяч жителів вмирають від них, причому 35 % померлих — особи працездатного віку. Кожну годину реєструють більше 20 нових випадків захворювання, а 10 мешканців України помирають від злоякісних пухлин. За дослідженнями та розрахунками фахівців, до 2020 року кількість уперше захворілих на злоякісне новоутворення в Україні перевищить 200 тисяч на рік. На 2004 рік рівень онкозахворюваності в цілому по Україні становив 325 на 100 тисяч населення, у м. Севастополі, Кіровоградській, Полтавській, Одеській та Запорізькій областях цей показник сягнув 365—475 на 100 тисяч населення. Що стосується показників смертності від онкологічних захворювань, то кожен другий-третій онкохворий в Україні вмирає в перший рік хвороби, що в 2-10 разів перевищує аналогічний показник в розвинених країнах. У той же час, близько 5 % людей з встановленим діагнозом злоякісної пухлини відмовляються від лікування через брак коштів.
Див. також
Примітки
Література
Джерела
Посилання
|
||||||||||||||||||||||