|
Diboraan
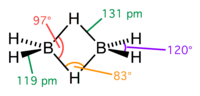
Diboraan is het eenvoudigste, min of meer stabiele hydride van boor. Het is het dimeer van monoboraan (BH3), dat niet stabiel is en dimeriseert tot diboraan. Diboraan is het molecule waarvoor het later breder toepasbare concept van de 3-centra-2-elektronbinding is ontwikkeld, waarbij twee waterstofatomen voorkomen als een brug tussen de booratomen. Er is maar één geschikt oplosmiddel voor diboraan bekend, namelijk tetrahydrofuraan (THF). In andere oplosmiddelen is het ofwel onvoldoende oplosbaar, ofwel reageert diboraan ermee. Diboraan reageert ook met THF, zij het langzaam en de oplossing kan gestabiliseerd worden door er een sulfide aan toe te voegen zoals dimethylsulfide.[1] SyntheseEr bestaan diverse methoden om diboraan te bereiden. Het wordt industrieel bereid door de reductie van een boorhalide met een hydride van een alkalimetaal, bijvoorbeeld van boortrifluoride met natriumhydride: Een andere methode is de reductie van boortrichloride (BCl3) met natriumhydride of met waterstof over een aluminiumkatalysator: De reactie van natriumboorhydride (NaBH4) met di-jood of met zwavelzuur (H2SO4) geeft ook diboraan: ToepassingenDiboraan wordt gebruikt als reagens in hydroboreringen, voor de vorming van organische boranen. Het wordt ook gebruikt als reductiemiddel; het kan gemakkelijk carbonzuren reduceren tot de corresponderende alcoholen. Diboraan kan hierbij gebruikt worden in THF-oplossing, omdat dit minder risico's inhoudt dan het gebruik van gasvormig diboraan. Een voorbeeld van hydroborering is de omzetting van alkenen (met R een niet nader bepaalde restgroep) in trialkylboranen, die verder kunnen omgezet worden in andere verbindingen en die ook toepassing vinden in katalysatoren voor de polymerisatie van olefinen:[2] Boranen, waaronder diboraan, zetten bij verbranding veel energie vrij en zijn daarom onderzocht als raketbrandstof. Diboraan zelf blijkt hiervoor echter minder geschikt, omdat het niet stabiel genoeg is en er bij de verbranding boortrioxide gevormd wordt, dat de raketmotoren kan verstoppen. Uit diboraan worden wel hogere boorhydriden gevormd die stabieler zijn en wel geschikt als brandstof. Diboraan wordt ook gebruikt als vulkanisatiemiddel van rubber en als een katalysator voor de polymerisatie van olefinen. Bij de productie van halfgeleidermaterialen wordt het gebruikt als doteringsmiddel voor de productie van p-type halfgeleiders. Toxicologie en veiligheidDiboraan is een ontvlambaar gas, dat in vochtige lucht uit zichzelf kan ontbranden. Het vormt met lucht explosieve mengsels in een breed concentratiebereik van 0,9 tot 98 volumeprocent. De verbrandingswarmte van diboraan is groter dan die van een vergelijkbaar koolwaterstof zoals ethaan. Blusschuim op basis van eiwitten is een geschikt blusmiddel; geen water want met water reageert diboraan tot waterstof en boorzuur. Diboraan is corrosief voor de ogen, de huid en de luchtwegen. Inademing ervan kan longoedeem veroorzaken. De drempelwaarde voor blootstelling aan de stof is 0,1 ppm of 0,11 mg/m3 (tijdgewogen gemiddelde over 8 uur). Diboraan heeft een afstotende geur, maar de geurdrempel van diboraan ligt tussen 2 en 4 ppm en is dus hoger dan de drempelwaarde, wat betekent dat er geen waarschuwende geur is bij het bereiken of overschrijden van een voor de gezondheid gevaarlijke concentratie. Diboraan wordt in cilinders als samengeperst gas geleverd. De opslag moet gekoeld gebeuren om de ontbinding van diboraan te vermijden. Zie ookExterne linkBronnen, noten en/of referenties
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||