|
Cremallera de leucina Una cremallera de leucina es un motivo estructural supersecundario de proteínas que crea fuerzas de adhesión a través de hélices alfa en paralelo. Es un dominio de dimerización común en proteínas involucradas en la expresión génica. Estructura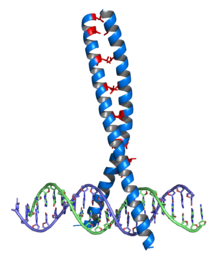 La principal característica del dominio de cremallera de leucina es la predominancia del aminoácido leucina en la posición "d" de la repetición del grupo de siete aminoácidos. Las cremallera de leucina fueron primero identificadas como alineamiento de secuencia de ciertos factores de transcripción en los que se identificaba un patrón común de leucinas cada siete aminoácidos. Posteriormente se descubrió que estas leucinas formaban un núcleo hidrofóbico de una superhélice. Cada mitad de la cremallera de leucina es una corta hélice alfa con un residuo de leucina cada siete posiciones. La conformación estándar de 3,6 residuos por giro de la estructura de hélice alfa cambia ligeramente a 3,5 residuos por giro de hélice. Cada leucina se encuentra en contacto con la leucina de la otra hélice cada dos giros. La familia de factores de transcripción bZip consiste en una región básica que interacciona con el surco mayor de la molécula de ADN a través de enlaces de hidrógeno, y una región hidrofóbica de cierre, que es la responsable de la dimerización. BiologíaLas proteínas reguladoras con el motivo cremallera de leucina incluyen c-fos y c-jun (el factor de transcripción AP1), son importantes reguladores del desarrollo. Si son producidos en exceso o mutados en un área vital, pueden generar cáncer. Estas proteínas interaccionan con el ADN como dímeros (homo- o hetero-) y son llamadas cremalleras de leucina básicas o bZips por sus siglas en inglés. Referencias
Enlaces externos |