|
Calç
 La calç són diferents materials obtinguts de la cocció de la pedra calcària, principalment l'òxid de calci o calç viva,[1] però també els seus derivats.[2] Quan es troba a la natura, la calç també és considerada com un mineral de la classe dels òxids. Característiques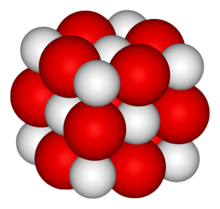  La calç és un òxid de fórmula química CaO, que cristal·litza en el sistema isomètric. És de color blanc, de poca duresa, lleugera i si es posa en contacte amb la pell és perjudicial. És un aglomerant molt utilitzat com a base de mescles, per a emblanquinar i com a aglutinant de pigments i pintures. La pedra de calç s'acostuma a coure en forns a una temperatura d'entre 1.000 °C i 1.200 °C, que transforma el carbonat de calci (CaCO₃) en òxid de calci (CaO) (calç viva). En combinar-la amb aigua, s'hidrata (o sigui, es transforma en hidròxid de calci (Ca(OH)₂) i desprèn calor. La calç hidratada (calç apagada o calç aèria), exposada a l'aire, es carbonata, o sigui, es combina amb el diòxid de carboni (CO₂) de l'aire per tornar a formar carbonat de calci. La calç, segons el tractament a què se sotmet pot ser:
El material obtingut coent pedra calcària amb una determinada porció d'argila, s'anomena calç hidràulica i té la propietat d'endurir-se dins l'aigua, perquè l'enduriment es produeix per reacció química entre l'hidròxid de calci, els silicats (procedents de l'argila) i l'aigua, pel que no és necessari el contacte amb en diòxid de carboni de l'aire. Segons la classificació de Nickel-Strunz, la calç és un mineral que pertany a "04.AB: Òxids amb proporció Metall:Oxigen = 2,1 i 1:1, amb Catió:Anió (M:O) = 2:1 (i 1,8:1)" juntament amb els següents minerals: crednerita, tenorita, delafossita, mcconnel·lita, bromellita, zincita, bunsenita, manganosita, monteponita, períclasi, wüstita i pal·ladinita. Ús de la calçLa calç té molts usos diferents, dels que podem destacar:
Bótes encalcinades
Amb aquest sistema l'aigua de la bota es va mantenir en perfecte estat els sis mesos que va durar el viatge. La capa de calç de l'interior de la bota preserva de la corrupció de l'aigua.
Referències
|