|
Mekanisme reaksiDalam ilmu kimia, suatu mekanisme reaksi adalah tahap demi tahap sekuensial reaksi elementer sehingga terjadi perubahan kimia menyeluruh.[1] Suatu mekansime kimia menjelaskan secara detail kejadian tepatnya pada setiap tahapan suatu reaksi kimia (transformasi). Ini juga menjelaskan masing-masing senyawa antara reaktif, kompleks aktif, keadaan transisi, pemutusan ikatan (dan urutan pemutusannya), serta pembentukan ikatan (dan urutan pembentukannya). Suatu mekanisme lengkap harus juga memperhitungkan semua pereaksi yang digunakan, fungsi katalis, stereokimia, seluruh produk yang terbentuk beserta masing-masing jumlahnya. Mekanisme reaksi juga harus menjelaskan laju relatif masing-masing tahapan dan persamaan laju reaksi secara keseluruhan. Zat antara reaksi (intermediat) adalah spesies kimia, sering kali tidak stabil dan berumur singkat, yang bukan pereaksi maupun produk dalam keseluruhan reaksi kimia, tetapi produk dan pereaksi sementara dalam tahap-tahap mekanisme reaksi. Zat antara reaksi sering kali berupa radikal bebas atau ion. Keadaan transisi dapat berupa keadaan molekul intermediat tak stabil meskipun dalam reaksi elementer. Keadaan transisi umumnya berupa entitas molekul yang melibatkan sejumlah ikatan dan/atau geometri yang tidak stabil. Mereka sesuai dengan maksima koordinasi reaksi, dan titik pelana pada permukaan energi potensial untuk suatu reaksi.  Metode dorongan panah atau elektron sering digunakan dalam menggambarkan mekanisme reaksi; sebagai contoh, lihat ilustrasi mekanisme kondensasi benzoin pada bagian contoh di bawah. Mekanisme reaksi juga harus memperhitungkan urutan reaksi molekul. Seringkali yang muncul di permukaan merupakan konversi satu tahap, namun pada kenyataannya merupakan reaksi banyak tahap. Kinetika kimiaInformasi tentang mekanisme reaksi sering kali disajikan menggunakan kinetika kimia untuk menentukan persamaan laju reaksi dan orde reaksi masing-masing reaktan.[2] Sebagai contoh dapat dilihat pada reaksi berikut: Dalam kasus ini, percobaan telah menentukan bahwa reaksi ini berlangsung menurut hukum laju reaksi . Bentuk ini memberi petunjuk bahwa tahap penentu laju reaksi adalah reaksi antara dua molekul NO. Satu mekanisme yang mungkin untuk keseluruhan reaksi yang menjelaskan hukum laju reaksi adalah:
Masing-masing tahapan disebut tahapan elementer, dan masing-masing mempunyai hukum dan molekularitasnya sendiri. Tahapan elementer harus berupa penjumlahan yang menghasilkan reaksi original. (Artinya, jika kita menghilangkan seluruh molekul yang muncul bersamaan pada kedua sisi reaksi, kita menyisakan reaksi original.) Ketika menentukan hukum laju reaksi untuk keseluruhan reaksi, tahapan paling lambat adalah tahapan yang menentukan laju reaksi. Oleh karena tahapan pertama (pada reaksi di atas) adalah tahapan yang paling lambat, maka ia merupakan tahap penentu laju reaksi. Oleh karena tahapan tersebut melibatkan penyatuan dua molekul NO2, maka merupakan reaksi bimolekul dengan hukum laju reaksi . Reaksi lain dapat memiliki mekanisme beberapa tahap yang berurutan. Dalam kimia organik, salah satu mekanisme reaksi pertama yang diajukan adalah mekanisme reaksi kondensasi benzoin, pada tahun 1903 oleh A.J. Lapworth. 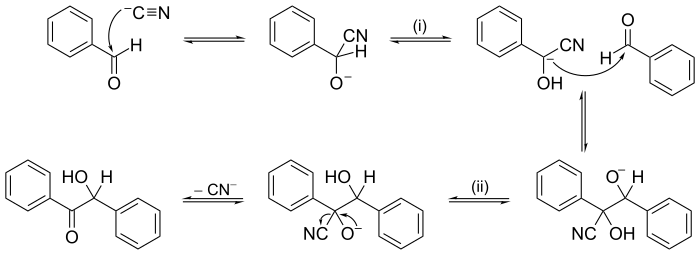 Terdapat juga mekanisme yang lebih kompleks seperti chain reactions, yang pada tahap-tahap propagasi membentuk siklus tertutup. Metode eksperimen lain uuntuk menentukan mekanismeBanyak rancangan eksperimen yang menyarankan kemungkinan urutan tahapan dalam suatu mekanisme reaksi, di antaranya:
Pemodelan teoretisMekanisme reaksi yang tepat adalah bagian penting untuk pemodelan prediktif yang akurat. Untuk kebanyakan sistem pembakaran dan plasma, mekanisme detailnya tidak tersedia atau memerlukan pengembangan lebih lanjut. Meskipun jika informasi tersedia, identifikasi dan rancang bangun data yang relevan dari beragam sumber, rekonsiliasi nilai-nilai yang berbeda serta ekstrapolasi kepada kondisi yang berbeda bisa menjadi proses yang rumit tanpa bantuan ahli. Tetapan laju reaksi atau data termokimia sering kali tidak tersedia dalam literatur, sehingga teknik kimia komputasi atau metode aditivitas golongan (bahasa Inggris: group additivity method) harus digunakan untuk memperoleh parameter yang diperlukan. Metode kimia komputasi dapat juga digunakan untuk menghitung energi potensial permukaan reaksi dan menentukan mekanisme yang mungkin.[15] MolekularitasMolekularitas dalam kimia adalah jumlah tumbukan entitas molekul yang terlibat dalam tahapan reaksi tunggal.
Secara umum, tahap-tahap reaksi yang melibatkan lebih dari tiga entitas molekul tidak akan terjadi. Lihat juga
Referensi
Pranala luar
|

![{\displaystyle r=k[NO_{2}]^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7c34576960b3342cceed6c0b51b1764beb2dfcf4)

