|
Substitusi nukleofilik aromatik Substitusi nukleofilik aromatik (disebut pula SNAr) adalah suatu reaksi substitusi dalam kimia organik di mana suatu nukleofil menggantikan suatu gugus pergi yang baik, seperti halida, pada cincin aromatik. Hal yang penting dalam mekanisme reaksi substitusi nukleofilik aromatik adalah, di mana gugus penarik elektron mengaktivasi cincin terhadap serangan nukleofilik, misalnya jika terdapat gugus fungsional nitro yang menempati posisi orto atau para terhadap gugus pergi halida. Tipe reaksiTerdapat 6 mekanisme substitusi nukleofilik yang melibatkan sistem aromatik, diantaranya:
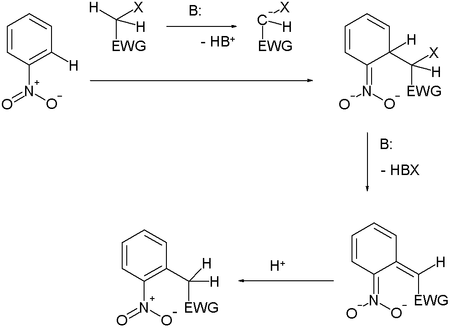
Mekanisme reaksi SNArAril halida tidak dapat menjalani reaksi SN2. Ikatan C–Br berada pada bidang cincin karena atom karbon memiliki geometri trigonal. Untuk menyerang dari belakang, nukleofil tersebut akan harus muncul di dalam cincin benzena serta membalikkan atom karbon dengan cara yang mustahil. Reaksi ini tidak memungkinkan.[1] Reaksi SN1 dimungkinkan tetapi sangat tidak menguntungkan. Hal ini akan melibatkan hilangnya gugus pergi tanpa bantuan dan pembentukan kation aril.[1] Berikut ini adalah mekanisme reaksi dari substitusi nukleofilik aromatik 2,4-dinitroklorobenzena dalam suatu larutan basa.
Dalam urutan ini karbon diberi nomor searah jarum jam 1-6 dimulai dengan karbon 1 pada pukul 12, yang terikat klorida. Sejak gugus nitro berada merupakan pengaktivasi ke arah substitusi nukleofilik, serta pengarah meta, memungkinkan karbon benzena yang berikatan untuk memiliki muatan negatif. Dalam kompleks Meisenheimer, elektron tak-berikatan pada karbanion menjadi berikatan dengan sistem pi aromatik yang memungkinkan karbon ipso untuk sementara terikat dengan gugus hidroksil (-OH). Agar dapat kembali kepada keadaan energi yang lebih rendah, baik gugus hidroksil lepas, atau klorida lepas. Dalam larutan kedua proses tersebut terjadi. Sebagian kecil zat antara melepaskan klorida untuk menjadi produk (2,4-dinitrofenol), sementara sisanya kembali kepada reaktan. Karena 2,4-dinitrofenol dalam keadaan energi yang lebih rendah tidak akan kembali membentuk reaktan, maka setelah beberapa waktu berlalu, reaksi mencapai kesetimbangan kimia yang menguntungkan 2,4-dinitrophenol. Pembentukan kompleks Meisenheimer yang terstabilkan dengan resonansi berjalan lambat karena berada dalam suatu keadaan energi yang lebih tinggi dari reaktan aromatik. Lepasnya klorida berlangsung dengan cepat, karena cincin menjadi aromatik kembali. Reaksi substitusi nukleofilik aromatikBeberapa reaksi substitusi yang khas dari hidrokarbon aromatik diantaranya:
Substitusi nukleofilik aromatik tidak terbatas pada hidrokarbon aromatik, namun; reaksi berlangsung lebih mudah dengan heteroarena. piridina khususnya reaktif ketika tersubstitusi pada posisi orto aromatik atau posisi para aromatik karena kemudian muatan negatif secara efektif terdelokalisasi pada posisi nitrogen. Salah satu reaksi klasik adalah reaksi Chichibabin (Aleksei Chichibabin, 1914) di mana piridina direaksikan dengan amida alkali-logam seperti natrium amida membentuk 2-Aminopiridina.[2] Dalam senyawa metil 3-nitropiridina-4-karboksilat, gugus nitro meta sebenarnya digantikan oleh fluorin dengan cesium fluorida dalam DMSO pada suhu 120 °C.[3] 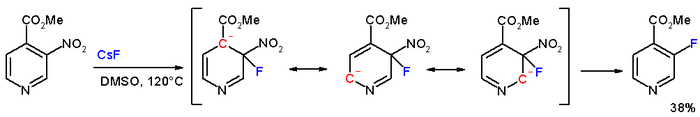 Substitusi nukleofilik aromatik asimetrisDengan nukleofil karbon seperti senyawa 1,3-dikarbonil reaksi telah dibuktikan sebagai metode untuk sintesis asimetris molekul kiral.[4] Pertama kali dilaporkan tahun 2005, organokatalis (berperan ganda dengan katalis transfer fasa) berasal dari cinconidin (terbenzilasi pada N dan O).
Lihat pulaWikimedia Commons memiliki media mengenai Nucleophilic aromatic substitution reactions.
Referensi
|