|
Хлорид натрію
Хлори́д на́трію (NaCl), у побуті відомий як сіль — тверда, прозора (у чистому вигляді) хімічна сполука з іонною кристалічною ґраткою, солона на смак. При розчиненні у воді повністю дисоціює на катіони натрію та хлорид-аніони.  Зустрічається в природі в розчиненому стані в солоних водоймах: у морях, океанах, озерах. У кристалічному стані входить до мінералу галіт, з якого практично повністю складається видобувна кам'яна сіль, морська сіль тощо. Залежно від походження природного хлориду натрію, має різну ступінь чистоти та різний кількісний та якісний склад домішок, які зумовлюють його смак та колір. Хлорид натрію, який застосовується в побуті, часто звуть кухонною, харчовою чи столовою сіллю; у назві іноді вказується на джерело її походження (кам'яна, морська, озерна, виварна) та — ґатунок: чим вищий, тим менше домішок містить хлорид натрію. У воді хлорид натрію розчиняється, але в чистому виді, на відміну від кухонної солі, не гігроскопічний, — не сиріє. Хлорид натрію використовується дуже широко: окрім застосування в кулінарії (як приправа до їжі і при консервуванні риби, м'яса та інших харчових продуктів), є також важливою сировиною хімічної промисловості для одержання гідроксиду натрію, соди, хлору тощо. Щорічний світовий видобуток хлориду натрію становить сотні мільйонів тонн, з яких майже 30 % використовується в харчовій промисловості. Поширення в природіУ природі хлорид натрію зустрічається у вигляді мінералу галіту, який утворює поклади кам'яної солі серед осадових гірських порід, прошарки і лінзи на берегах солоних озер і лиманів, соляні кірки в солончаках та на стінках кратерів вулканів і в сольфатарах. Величезна кількість хлориду натрію розчинена у морській воді. Світовий океан містить 4×1015 тонн NaCl, тобто з кожної тисячі тонн морської води можна отримати в середньому 1,3 тонни хлориду натрію. Сліди NaCl постійно містяться в атмосфері внаслідок випаровування бризок морської води. У хмарах на висоті півтора кілометра 30% крапель, більших 10 мкм за розміром, складаються з NaCl. Також його знайдено у кристалах снігу[4]. Найімовірніше, що перше знайомство людини із сіллю відбулося в лагунах теплих морів або на соляних озерах, де на мілководді солона вода інтенсивно випарювалась під дією високої температури і вітру, а в осаді накопичувалась сіль. За образним виразом:
ГалітУ природі хлорид натрію найчастіше зустрічається у вигляді мінералу галіту. Він має гранецентровану кубічну ґратку і містить 39,34 % Na, 60,66 % Cl. Іншими хімічними елементами, що входять до складу домішок, є: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Густина 2,1—2,2 г/см³, а твердість за шкалою Мооса — 2. Безбарвний, прозорий мінерал, зі скляним блиском. Поширений мінерал соленосних товщ. Утворюється при осадженні у замкнених водоймах, а також як продукт згону на стінках кратерів вулканів. Складає пласти в осадових породах лагунних та морських фацій, штокоподібні тіла в соляних куполах тощо[6]. Кам'яна сільКам'яною сіллю називають осадову гірську породу з групи евапоритів, складену більше ніж на 90% з галіту. Галіт також часто називають кам'яною сіллю. Ця осадова гірська порода може бути безбарвною або сніжно-білою, але частіше її забарвлено домішками глин, тальку (сірий колір), оксидами та гідроксидами заліза (жовтий, помаранчевий, рожевий, червоний), бітумами (бурий). Кам'яна сіль містить хлориди і сульфати натрію, калію, магнію і кальцію, броміди, йодиди, борати, гіпс, домішки карбонатно-глинистого матеріалу, доломіту, анкериту, магнезиту, бітумів тощо[6]. За умовами формування родовищ кам'яну сіль поділяють на такі види[6]:
Морська сільМорська сіль є сумішшю солей (хлориди, карбонати, сульфати тощо), що утворюється за повного випаровування морської води. Середній вміст солей в морській воді становить:
 Під час випаровування морської води за температури 20 — 35 °C в осаді спочатку кристалізуються найменш розчинні солі — карбонати кальцію та магнію і сульфат кальцію. Потім випадають більш розчинні сульфати натрію і магнію, хлориди натрію, калію і магнію, і після них — сульфати калію і магнію. Послідовність кристалізації солей і склад осаду може дещо змінюватись залежно від температури, швидкості випаровування та інших умов. У промисловості морську сіль отримують з морської води, здебільшого методом звичайного випарювання. Вона відрізняється від кам'яної солі значно більшим вмістом інших хімічних солей, мінералів та різних мікроелементів, в першу чергу йоду, калію, магнію та мангану. Відповідно вона відрізняється від хлориду натрію за смаком — гірко-солоний присмак їй надають солі магнію. Вона використовується в медицині: при лікуванні шкірних захворювань, таких як псоріаз. Як лікувальна речовина в аптечній та звичайній торговельній мережі поширеним продуктом є сіль з Мертвого моря. В очищеному вигляді цей вид солі також пропонується у продуктовій торговельній мережі — як натуральна та багата на йод харчова[7]. ПокладиПоклади кам'яної солі відомі у всіх геологічних системах. Найважливіші з них зосереджено у кембрійських, девонських, пермських і третинних відкладах. Кам'яна сіль складає потужні пластові поклади і ядра склепінчастих структур (соляних куполів і штоків), утворює прошарки, лінзи, гнізда і вкраплення в інших породах[6]. Україна має великі та унікальні за якістю поклади солі, де у потужних пластах на незначних глибинах залягають ресурси дуже високої якості [8]. За хімічною чистотою їх можна вважати найкращими у світі. Також родовища кам'яної солі є у Придніпровській низовини, Прикарпатті, Закарпатті, Переддобруджі а також у Криму[9]:
Крім кам'яної солі є родовища у вигляді ропи соляних озер (Сиваське та Сасик-Сиваське), а також підземні розсоли. Запаси кам'яної солі та природних розсолів в Україні досить значні і за сучасного рівня видобутку практично невичерпні (їх запаси становлять понад 9 млрд т за категоріями А + В + С1[9]). ВиробництвоІсторіяДеякі дослідники вважають, що сіль була першим мінералом, який люди видобували в шахтах. Так, є дані, що свідчать про видобування в неглибоко залягаючих пластах солі колодязним методом ще в бронзову добу поблизу Зальцбургу[10]. У 3—4 тисячолітті до н.е. племена, які мешкали в долинах рік Хуанхе і Янцзи та на рівнині біля Печилейської затоки виварювали сіль. В епоху династії Чжоу (1125—1255 до н. е.) були особливі чиновники, які завідували соляним промислом у Піднебесній. Вони зараховувались до придворної служби і називалися «янь-жень» — «соляні люди». Страбон описує родовища солі, а Діоскорід згадує видобуток солі з морської води. В середньовіччі першими містами Центральної Європи, які тісно пов'язані з сіллю, були Люнебург (956), Бад-Райхенгалль (1163) і Галлайн (1177). У IX столітті у Венеції були свої солеварні, що залишились ще з римських часів. Але сіль в них отримували тільки дрібну — крупнокристалічну доводилося імпортувати. А в XIII столітті низка повеней знищила половину венеційських солеварень і імпорт солі зріс ще більше. Тоді венеційці зробили важливе відкриття — спекуляція сіллю давала більше прибутку, ніж її виробництво. Уряд давав субсидії купцям за доставку солі до Венеції. У результаті це стало настільки вигідною справою, що ті ж самі купці, збагатившись, зайнялися ввезенням і інших потрібних товарів. Дорогі індійські прянощі, шовку, зерно — все йшло до Європи через Венецію. Але завжди від 30 до 50 відсотків усіх перевезень венеційців становила сіль. Поступово Венеція прибрала до рук всі європейські ринки солі. Купці просувалися все далі і далі по Середземномор'ю, купуючи сіль, а якщо вийде — то і самі солеварні, в Єгипті, Алжирі, Криму. Саме на регулюванні солі Венеція змогла звести розкішні громадські будівлі і побудувати складну гідравлічну систему для захисту від затоплення. Величний і чарівний вигляд міста, його статуї, собори і розписи були профінансовані «соляними» грошима. У давнину технологія видобування солі полягала в тому, що соляну ропу витягали кінським приводом із шахт, що звалися «криниці» або «вікна», і були досить глибокими — 60—90 м. Витягнуту суровицю виливали до особливого резервуару — творила, звідки вона через отвори стікала до нижнього резервуару — кадіба, а з останнього системою ринв подавалася до дерев'яних веж. Там її розливали у великі чани і черіні[a 1], на яких сіль виварювалася[11]. В Русі, потім в Україні займались переважно транспортуванням солі для власного вжитку та перепродажі з Криму в Скандинавію. Вода Світового океану має максимальний рівень розчиненої солі 35 ‰. Солоність Чорного моря вказано 7—18 ‰, але тільки використання мілководних лагун та безкоштовної енергії сонця робить видобуток морської солі економічно вигідним. Другим джерелом солі в Русі була солона ропа з Карпат. Грецькою мовою сіль звучить як "гальс", тому Галичина - "Галітова Земля" або "Земля Солі" походить від назви мінералу галіт – NaC. Фінанси від солі дозволяли місцевим княжим дворам проводити політику, відмінну від політики Київа. Сучасний видобуток хлориду натрію механізовано та автоматизовано. Сіль масово добувається випарюванням морської води (тоді її називають морською сіллю) чи ропи з інших ресурсів, таких як соляні джерела та соляні озера, а також розробкою соляних шахт та видобуванням кам'яної солі. Для видобування хлориду натрію з морської води необхідні умови жаркого клімату з низькою вологістю повітря, наявність значних низинних територій, що лежать нижче рівня моря або затоплюються припливом, слабка водопроникність ґрунту випарювальних басейнів, мала кількість опадів протягом сезону активного випаровування, відсутність впливу прісних річкових вод та наявність розвинутої транспортної інфраструктури. Сучасне виробництво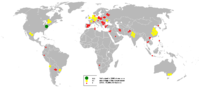  Світове виробництво солі 2012 року оцінюється в 280 мільйонів тон[12]. Найбільшими світовими виробниками є Китай (60,0 млн тон), США (45,0 млн тон), Німеччина (16,5 млн тон), Індія (15,8 млн тон) та Канада (14 млн тон)[13]. Лідером виробництва хлориду натрію у США є "Akzo Nobel Salt Inc." (входить до холдингової корпорації "Akzo Nobel"), потужності виробництв якої становлять понад 10 млн тон/рік. На ринку солевидобування США помітне місце мають такі компанії, як "Morton International" (6,3 млн тон/рік), "Cargill Inc." (3,9 млн тон/рік), "Carey Salt" (1,7 млн тон/рік). З 2003 року помітно виразне нарощування виробничих потужностей соляної промисловості Китаю і поступове повільне зменшення видобутку солі в США та Європі. За видобутком солі Україна (5,5 млн тон) посідає 11-е місце у світі та 3-є — в Європі (після Німеччини та Франції, остання — 6,0 млн тон)[14]. Видобування солі в країнах Європи належить в основному державам Центральної та Південної Європи. Лідери європейського ринку — Німеччина, Франція, Велика Британія, Польща, Іспанія, Італія, Нідерланди, Румунія. Норвегія, Швеція та Фінляндія майже не мають солевидобувних виробництв і імпортують хлорид натрію з інших країн ЄС. В Росії найбільшими виробниками хлориду натрію є: ВАТ «Бассоль», ВАТ «Тиретський солерудник», ВАТ «Сільвініт», ВАТ «Ілецьксоль» та ТзОВ Комбінат «Сибсоль». В Україні лідером солевидобувної промисловості є ДП «Артемсіль» з потужностями понад 7 млн тон/рік[15].
ЗастосуванняХлорид натрію є важливою речовиною, що забезпечує життєдіяльність людини, тваринного і рослинного світу, а також товаром, який має надзвичайно широкий спектр промислового застосування. Він є основою для виробництва багатьох хімічних продуктів, в першу чергу хлору і гідроокису натрію, без яких неможливо виробництво багатьох пластмас, алюмінію, паперу, мила, скла тощо. За підрахунками спеціалістів, хлорид натрію в умовах сучасної світової глобалізованої економіки прямо чи посередньо має більше 14 тисяч областей застосування[16]. У харчовій промисловості та кулінарії
 У харчовій промисловості та кулінарії використовують хлорид натрію, чистота якого має бути не менше 97%. Його застосовують як смакову добавку і для консервування харчових продуктів. Такий хлорид натрію має товарну назву кухонна сіль, часом також вживаються назви харчова, столова, а також уточнення назви залежно від її походження — кам'яна, морська, та за складом добавок — йодована, фторована тощо. Така сіль є кристалічним сипким продуктом з солоним смаком без присмаку, без запаху (за винятком йодованої солі), в якому не припускаються сторонні домішки, що не пов'язані з методом добуванні солі. Окрім хлориду натрію, кухонна сіль містить невелику кількість солей кальцію, магнію, калію, які надають їй гігроскопічності і жорсткості. Чим менше цих домішок у солі, тим вища її якість[17]. Виділяють ґатунки: екстра, вищий, перший і другий. Масова частка хлористого натрію у ґатунках, %:
Масова частка вологи у виварній солі сорту «екстра» 0,1 %, у вищому сорті 0,7 %. Припускаються добавки йодиду калію (йодистого калію), йодату калію (йоднуватокислого калію), фториду калію та фториду натрію. Масова частка йоду має складати (40,0 ± 15,0)×10−4 %, флуору (25,0 ± 5,0)×10−3 %[17]. Іноді в кухонну сіль додають інші допоміжні речовини, наприклад ферроціанід калію (E536 — неотруйну комплексну сіль Сmax10 мг/кг) як агента, що запобігає злипанню[18] Колір екстра та вищого ґатунків — білий, однак для першого та другого припускається сірий, жовтуватий, рожевий та голубуватий відтінки залежно від походження солі. Харчову кухонну сіль виробляють меленою і сіяною. За розміром зерен мелену сіль поділяють на номери: 0, 1, 2, 3. Що більший номер, то більші зерна солі[17]. У кулінарії хлорид натрію споживають як найважливішу приправу. Сіль має добре знайомий кожній людині характерний смак, без якого їжа здається прісною. Така особливість солі обумовлена фізіологією людини. Проте досить часто люди споживають солі більше, ніж потрібно для фізіологічних процесів. У США продаються різні харчові продукти, що рекламуються як «сіль з пониженим вмістом натрію» англ. low sodium salt. Зменшення вмісту натрію досягається за рахунок зниження кількості хлориду натрію на одиницю об'єму. Один з варіантів виробництва — часткове заміщення хлориду натрію іншими хімічними сполуками, такими як хлорид калію або магнію. Інший варіант — зміна габітусів кристалів солі («сніжинки» замість характерних призм), в результаті чого її об'ємна щільність зменшується (0,76 г/см³ проти 1,24 г/см³ у «звичайної» солі), і одна столова ложка продукту містить на третину менше натрію[19]. Хлорид натрію має слабкі антисептичні властивості — 10–15 % вміст солі запобігає розмноженню гнилісних бактерій. Цей факт обумовлює її широке застосування як консерванта.  В медициніІзотонічний розчин хлориду натрію у воді (0,9%) застосовується як дезінтоксикаційний засіб, для корекції стану систем організму у разі зневоднення, як розчинник інших лікарських препаратів. При падінні концентрації хлориду натрію у плазмі крові, вода переходить із судинного русла до міжтканинного простору і відбувається загущення крові. При значному дефіциті — спостерігаються судоми гладенької мускулатури і судомні скорочення скелетної, порушуються функції нервової та серцево-судинної систем. Гіпертонічні розчини застосовують у разі легеневих, шлункових і кишкових кровотеч; як допоміжний осмотичний діуретик для забезпечення форсованого діуреза; у станах, що характеризуються дефіцитом іонів натрію і хлору; у разі отруєння нітратом срібла; для обробки гнійних ран (місцево). В офтальмології як місцевий засіб розчин хлориду натрію має протинабрякову дію[20]. В оптиціКристали хлориду натрію прозорі для інфрачервоного спектра (довжини хвиль між 0,21 та 25 мкм)[21] і з них виготовляють лінзи, призми і вікна для інфрачервоних оптичних приладів. Наприклад, потужні імпульсні СО2-лазери, мають в своїй конструкції кілька лінз з високочистих кристалів хлориду натрію. У комунальному господарстві. Технічна сільВзимку хлорид натрію, забруднений домішками інших солей або піску чи глини — так звана технічна сіль — застосовується як антифриз проти ожеледиці. Нею посипають тротуари, хоча це негативно впливає на рослинність, спричиняє корозію споруд та автомобілів, пошкоджує шкіряне взуття. Регенерація Na-катіонітових фільтрівNa-катіонітові фільтри широко застосовуються в котельних установках всіх потужностей для пом'якшення води при водопідготовці. Як катіонітовий матеріал на сучасних водопідготовчих установках використовують в основному глауконіт, сульфоноване вугілля і синтетичні смоли. Найпоширеніше сульфовугілля.
Хімічна промисловістьПоряд із кам'яним вугіллям, вапняками і сіркою, сіль входить до так званої «великої четвірки» мінеральних сировин, які є найважливішими для хімічної промисловості[22]. З неї отримують соду, хлор, соляну кислоту, гідроксид натрію, сульфат натрію і металевий натрій. Окрім цього сіль використовується також для промислового отримання легкорозчинного у воді хлорату натрію, що є засобом для знищення бур'янів[23]. Сумарне рівняння реакції електролізу гарячого розчину хлориду натрію[24]:
Отримання хлору та гідроксиду натрію У промисловості шляхом електролізу концентрованого розчину хлориду натрію отримують хлор. Процеси, що відбуваються на електродах[25][26]:
Як видно з рівняння сумарної реакції ще одним продуктом є гідроксид натрію. Витрати електроенергії на 1 т хлору складають приблизно 2700 кВт×год. Отриманий хлор зріджується на жовту рідину вже за звичайної температури[27]. Якщо між анодом та катодом нема діафрагми, то розчинений у воді хлор починає реагувати з гідроксидом натрію, утворюючи хлорид та гіпохлорит натрію NaClO[26]:
Для уникнення цієї реакції при отриманні гідроксиду натрію з хлориду натрію застосовують діафрагму, а відповідний метод отримання NaOH називають діафрагмовим. Як діафрагму застосовують азбестовий картон. У процесі електролізу розчин хлориду натрію безперервно подається до анодного простору, а з катодного простору безперервно витікає розчин хлориду та гідроксиду натрію. Під час випарювання останнього хлорид кристалізується, оскільки його розчинність у 50% розчині NaOH мізерно мала (0,9%). Отриманий розчин NaOH випарюють у залізних чанах, після чого сухий залишок переплавляють. Для отримання чистого гідроксиду натрію (без домішок хлориду натрію) застосовують ртутний метод, де використовують графітовий анод та ртутний катод. Внаслідок того, що перенапруга виділення водню на ртуті дуже велика, на ній відновлюються іони натрію і утворюється амальгама натрію[26][28]:
Амальгаму пізніше розкладають гарячою водою з утворенням гідроксиду натрію та водню, а ртуть перекачують насосом назад до електролізера:
Сумарна реакція процесу така ж, як і у разі діафрагмового методу. Отримання металевого натріюМеталевий натрій отримують електролізом розплаву хлориду натрію. Відбуваються такі процеси:
Вана електролізеру складається зі сталевого кожуха з футеровкою, графітового аноду та кільцевого залізного катоду. Між катодом та анодом розташовано сітчасту діафрагму. Для зниження температури плавлення NaCl (800 °C), електролітом є не чистий хлорид натрію, а його суміш із хлоридом кальцію CaCl2 (40:60) із температурою плавлення 580 °C. Металевий натрій, що збирається у верхній частині катодного простору, містить до 5% домішку кальцію, але останній згодом майже повністю відділяється, оскільки його розчинність у рідкому натрії за температури його плавлення (371 °C) становить лише 0,01 %. Із витрачанням NaCl його постійно додають до ванни. Витрати електроенергії складають приблизно 15 кВт×год на 1 кг натрію[29]. Отримання соляної кислоти та сульфату натріюСеред багатьох промислових методів отримання соляної кислоти, тобто розчину хлороводню (HCl) у воді, застосовується реакція обміну між хлоридом натрію та сірчаною кислотою:
Перша реакція відбувається значною мірою вже за звичайних умов, а за слабкого нагрівання йде майже до кінця. Друга відбувається лише за високих температур. Процес здійснюється в спеціальних механізованих печах великої потужності. Хлороводень, що виділяється, знепилюють, охолоджують та поглинають водою з утворенням соляної кислоти. Як побічний продукт утворюється сульфат натрію Na2SO4[30][31]. Цей метод застосовується також для отримання хлороводню в лабораторних умовах. Фізичні та фізико-хімічні властивості  Хлорид натрію добре розчиняється у воді (5,8 моль/л при 18 °C)[32]. Зі зростанням температури розчинність солі дуже повільно збільшується. У чистому вигляді хлорид натрію не гігроскопічний. Однак сіль часто буває забруднена домішками (здебільшого іонами Ca2+, Mg2+ та SO2− Суміш подрібненого льоду із дрібним порошком хлориду натрію є ефективним охолоджувачем. Так, суміш складу 30 г NaCl на 100 г льоду охолоджується до температури –20 °C. Це відбувається через те, що водний розчин солі замерзає за температури нижче 0 °C. Лід, що має температуру близько 0 °C, плавиться в такому розчині, поглинаючи тепло навколишнього середовища.
Густина і концентрація водних розчинів NaCl
Лабораторне отримання та хімічні властивостіЗважаючи на величезні природні запаси хлориду натрію, необхідності в його промисловому чи лабораторному синтезі немає. Однак його можна отримати різними хімічними методами як основний чи побічний продукт.
Оскільки хлорид натрію у водному розчині майже повністю дисоційований на іони: NaCl → Na+ + Cl−, його хімічні властивості у водному розчині визначаються відповідними хімічними властивостями катіонів натрію та хлорид-аніонів. Структура  Хлорид натрію утворює кристали кубічної сингонії. На зображенні більші іони хлору Cl− показано зеленими сферами, а менші іони натрію — сірими. Вони заповнюють всі проміжки в кубі. Кожен з іонів Cl− оточено шістьма іонами Na+ в октаедральній конфігурації, і навпаки. Якщо подумки викинути, наприклад, іони Na+, то залишиться щільно упакована кубічна структура з іонів Cl−, яка називається гранецентрованою кубічною ґраткою (скорочено ГЦК — гранцентрована кубічна). Іони Na+ теж утворюють щільно упаковану кубічну ґратку. Таким чином, кристал складається із двох ГЦК підграток, зсунутих одна відносно іншої на півперіоду. Така ж ґратка характерна для багатьох інших мінералів. Параметр кристалічної ґратки — a = 564,02 пм. У кристалічній ґратці між атомами переважає іонний хімічний зв'язок, що є наслідком дії електростатичної взаємодії протилежних за зарядом іонів. Біологічна функціяЛюдина щорічно споживає в середньому близько 5 кг хлориду натрію[37]. Кров, якої в організмі дорослої людини близько 5 літрів, містить близько 0,9 % NaCl. Щоденне виділення хлориду натрію із сечею становить зазвичай близько 15 г. В людському поті міститься близько 0,5 % NaCl, а тому у разі посиленого потовиділення рекомендовано вживати газовану воду, що містить 0,5 % NaCl[4]. Фізіологічно обґрунтована добова норма споживання солі у помірному кліматі для людини середньої маси у віці 30 років становить 4-6 грамів, однак у багатьох країнах вона традиційно значно вища — приблизно 10-20 грамів, а в умовах спекотного клімату через підвищене потовиділення — до 25–30 г. У разі екстремальних навантажень на організм добова потреба в солі може сягати 100–150 г. Сіль є регулятором осмотичного тиску, водяного обміну, сприяє утворенню соляної кислоти шлункового соку, активізує діяльність ферментів. Але надмірне вживання солі призводить до підвищення кров'яного тиску, хвороб нирок та серця. Нестача солі в організмі викликає руйнування кісткової і м'язової тканин. Вона може спричинити депресію, нервові розлади, погіршення травлення і серцево-судинної діяльності, спазми гладенької мускулатури, остеопороз, анорексію. У разі хронічної нестачі хлориду натрію в організмі можливі летальні випадки. Оскільки в Україні солиться в процесі виробництва більшість вироблених фабрично продуктів, як то ковбаса, сир, хліб тощо, фактично для того, щоб залишитися в межах норми споживання, треба або взагалі не солити їжу, або ж солити зовсім трошки. Свійські тварини (корови, вівці, коні, кози) також потребують солі не менше за людину. Нестача хлориду натрію в організмі молодої тварини спричиняє затримку в рості і наборі ваги, а у дорослої — в'ялість, втрату апетиту, зниження надоїв молока і часткову втрату ваги. Оскільки корми і листя рослин містять мало солі, на сучасних фермах її додають до складу комбікормів і додатково також збагачують вітамінами і мінеральними речовинами, необхідними для здоров'я скотини. У культурі і побутіХлорид натрію, як сіль відіграє значну роль у культурі багатьох народів землі. Ще за часів Стародавнього Єгипту сіль вважалася «нечистою». У всіх країнах стародавнього світу сіль, як символ прокляття, було заведено розкидати на руїни завойованого і приреченого на знищення міста. Це робилося з метою приректи місто на вічне безпліддя, за відповідністю з посипанням сіллю родючої землі, після чого на ній вже нічого не росло.
З іншого боку сіль уособлювала сталість і вірність. У всіх народів Близького сходу під час укладання договору миру вживання солі отримало символічне значення. Тому у давніх євреїв найбільш священні і нерозривні завіти називалися «завітами солі».
Під час п'ятничної вечері євреї занурюють в сіль «хліб Шабату». В юдаїзмі хліб вважається символом дару Божого, і занурення хліба у сіль символізує його зберігання — тобто підтвердження завіту між Богом і євреями. В Ефіопії сіль також вважають символом дружби — гостю подають кусок солі, а той повинен лизнути його[39]. Древні тевтони під час клятви опускали палець до глечика із сіллю. Тюркські і арабські племена укладали союзи і договори, виголошуючи клятву вірності над посудом із сіллю, заїдаючи її хлібом із сіллю. Пліній Старший описує, що римський полководець Гней Помпей, коли захопив палац понтійського володаря Мітрідата, знайшов у його таємних архівах власноручно написаний ним рецепт ліків, складений із суміші висушених горіхів, фіг і листочків рути, з добавкою крупинки солі (лат. addito salis grano). Ці ліки, прийняті зранку натщесерце, нібито упродовж цілого дня могли вберегти людину від дії отрути. У кельтів, греків, грузин, вірмен, татар, курдів довго зберігався звичай «солити» новонароджених для охорони від злих духів — хвороб і безсоння. З часів середньовіччя серед військових було поширене уявлення, що сіль береже в бою від поранень і смерті. Навіть у часи Другої світової війни солдати брали з собою на фронт калитку з грудкою рідної землі, що була змішана з сіллю. Майже у всіх народів світу у казках і міфах є згадки про сіль, яка є потужним оберегом проти чаклунства, злих духів і численних напастей і бід. Також відомі давні приказки, що визначають виняткову роль солі для людини:
Якщо дівчина пересолить борщ — значить закохалась (себто неуважна, думає не про куховаріння, а про свого милого). У середньовічній Англії на шляхетському бенкету срібну сільницю зі сіллю ставили біля найшанованішого гостя. Звідси англійські ідіоми: англ. sit above the salt — «сидіти перед сіллю», тобто займати почесне місце; та англ. sit below the salt — «сидіти за сіллю», тобто займати скромне, низьке положення. Латинський вираз лат. cum grano salis означає дослівно «з крупинкою солі» — тобто ставитися до чогось з долею іронії, з обережністю, недовірливо. Цікаві факти
Див. також
Примітки
Джерела
Посилання
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||















