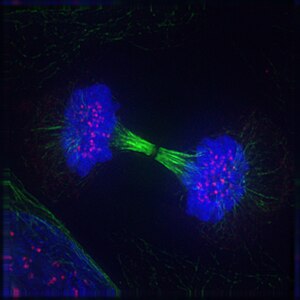
|
Telofase Telofase (del grec; τέλος (télos), «final» + φάσις (fàsis), «etapa» ; «etapa final») és l'estadi final tant en la meiosi com en la mitosi, després del procés de l'anafase, d'una cèl·lula eucariota. Durant la telofase, es reverteixen els efectes de la profase i de la prometafase (quan es desintegren el nucli i la membrana nuclear). A mesura que els cromosomes arriben als pols de les cèl·lules, es crea una membrana nuclear al voltant de cada conjunt de cromàtides, els nuclèols tornen a aparèixer, i els cromosomes comencen a decondensar per formar de nou la cromatina que es troba present durant la interfase. Es desfà el fus acromàtic i es despolimeritzen els eixos dels microtúbuls. La citoquinesi comença abans de la telofase tardana i, quan es completa, segrega els dos nuclis fills entre un parell de cèl·lules filles separades.[1] La telofase es basa principalment en la defosforilació de substrats de cinasa dependent de ciclina (Cdk).[2] La telofase representa aproximadament el 2% de la durada del cicle cel·lular. Un cop finalitzada la telofase, la mitosi és completa i la cèl·lula passa a l'estadi d'interfase. MitosiDurant aquesta fase:
La darrera fase de la telofase s'anomena citodieresi. És la separació de la cèl·lula mare en dues cèl·lules filles. A les cèl·lules animals, un solc de divisió separa la cèl·lula en dues, sota l'acció d'un anell contràctil intracel·lular format per microfilaments d'actina que s'enllacen amb molècules de miosina. L'actina i la miosina són dues de les molècules responsables de la contracció muscular. L'anell contràctil està format per la contracció de la miosina i l'actina. És aquesta contracció la que disminuirà la mida de l'anell i provocarà així la separació de la cèl·lula en dues cèl·lules. Els microtúbuls astrals, que tenen un paper important en la formació del pla equatorial, influeixen en la ubicació del solc de divisió. MeiosiDurant la meiosi succeeixen dos processos de divisió del nucli, la meiosi I (dividida en profase I, metafase I, anafase I i telofase I), i la meiosi II (dividida en profase II, metafase II, anafase II i telofase II).
La desfosforilació de substrats de CdkLa fosforilació de les dianes de proteïnes de la M-Cdk (cinasa dependent de ciclina de la mitosi) produeix la creació del fus acromàtic, la condensació dels cromosomes i la descomposició de la membrana nuclear al principi de la mitosi. La desfosforilació d'aquests mateixos substrats produeix el desmuntatge dels fusos, la descondensació de cromosomes i la reconstrucció dels nuclis fills durant la telofase. L'establiment d'un grau de desfosforilació permissible als esdeveniments de la telofase requereix tant la inactivació dels substrats de Cdk com l'activació de fosfatases. La inactivació de la Cdk és principalment el resultat de la destrucció de la seva ciclina associada. Les ciclines estan orientades a la degradació proteolítica pel complex promotor de l'anafase (APC/C, anaphase promoting complex), també conegut com a ciclosoma,[3] una ubiquitina-ligasa. El complex proteic APC-CDC20 (APC/CCDC20) s'adreça a les ciclines mitòtiques per a la degradació que s'inicia durant l'anafase.[4] L'addició experimental de M-ciclina no degradable a les cèl·lules indueix l'aturada del cicle cel·lular en un estat post-anafase / pre-telofase, amb cromosomes condensats capturats als pols cel·lulars, un fus acromàtic intacte i cap modificació de la membrana nuclear. Això s'ha demostrat en els òvuls de granota (Xenopus) i de les mosques del vinagre (Drosophilla melanogaster), en el rent de la cervesa (Saccharomyces cerevisiae), en el rent de fissió (Schizosaccharomyces pombe), i en diverses línies de cèl·lules humanes.[5] El requeriment per a l'activació de la fosfatasa es pot observar en el rent que es reprodueix per gemmació, que no té fosfatases redundants per finalitzar la mitosi i que confien en la fosfatasa cdc14. El bloqueig per l'activació de cdc14 en aquestes cèl·lules es tradueix de la mateixa manera que la detenció fenotípica que bloqueja la degradació de la M-ciclina.[2][4] Històricament, s'ha pensat que l'anafase i la telofase són esdeveniments que es produeixen passivament després de la satisfacció del punt de control de l'assemblatge del fus (SAC, spindle-assembly checkpoint) que defineix la transició metafase-anafase.[6] Tanmateix, l'existència de fases diferencials a l'activitat de cdc14 entre anafase i telofase suggereixen que existeixen punts de control mitòtics addicionals desconeguts. El cdc14 s'activa pel seu alliberament del nucli (de la seva captura dins del nuclèol) i posterior exportació al citoplasma. La ruta d'alliberament del cdc14 durant l'anafase primerenca (que estabilitza el fus acromàtic) també allibera cdc14 del nucli, però el restringeix al nucli. L'alliberament complet i el manteniment de l'activació del cdc14 s'assoleix mitjançant la separació de la ruta de la xarxa de sortida mitòtica (MEN, Mitotic Exit Network) fins a un grau suficient per desencadenar el desmuntatge del fus acromàtic i tornar a crear la membrana nuclear, després d'una anafase tardana.[7][8] La desfosforilació mediada per cdc14 activa processos de regulació posteriors exclusius per a telofase. Per exemple, la desfosforilació del CDH1 permet a l'APC/C unir-se amb CDH1. L'APC/CCDH1 marca el CDC20 per a la proteòlisi, donant com a resultat un canvi cel·lular de l'activitat APC/CCDC20 a l'activitat APC/CCDH1.[5] La ubiqüitinació de les ciclines mitòtiques continua juntament amb la dels objectius específics d'APC/CCDH1 com el component del fus acromàtic del rent (Ase1)[2] i del cdc5, la degradació dels quals és necessària per al retorn de les cèl·lules a la fase G1.[8] Mecanismes addicionals de la conducció de la telofaseUn canvi en el perfil de fosfoproteïnes a tota la cèl·lula és només el més ampli de molts mecanismes reguladors que contribueixen a l'aparició d'esdeveniments individuals de durant la telofase.
El desmuntatge del fus acromàticEl trencament del fus acromàtic, comú a l'acabament de la mitosi en tots els eucariotes, és l'esdeveniment que s'utilitza més sovint per definir la transició de l'anafase B a la telofase,[2][6] tot i que l'inici del muntatge de la membrana nuclear tendeix a precedir el del desmuntatge del fus.[11] El desmuntatge del fus és un procés irreversible que no ha d'afectar la degradació definitiva, sinó la reorganització dels microtúbuls constituents; els microtúbuls se separen dels cinetocors i dels centrosomes, i tornen als seus estats d'interfase. La despolimerització del fus acromàtic durant la telofase es produeix des de l'extrem més llunyà i és, d'aquesta manera, l'operació inversa del muntatge del fus.[12] El conjunt posterior de la matriu de microtúbuls és, a diferència del fus polaritzat, interpolar. Això és especialment aparent en les cèl·lules animals que de forma immediata, després del desmuntatge del fus acromàtic, han d'establir el feix antiparal·lel de microtúbuls conegut com a fus central per tal de regular la citoquinesi.[2] Es requireix de l'ATPasa p97 per l'establiment de matrius de microtúbuls d'interfase relativament estables i llargues després del desmuntatge del fus acromàtic altament dinàmic i relativament curt.[9]
Si bé el conjunt del fus acromàtic ha estat estudiat i caracteritzat com un procés en què les estructures provisionals són edificades pel SAC, la base molecular del desmuntatge del fus encara no s'entén amb detalls comparables. La cascada de desfosforilació mitòtica tardana dels substrats de M-Cdk per la xarxa de sortida de la mitosi (MEN, mitosis exit network) és considerada com a responsable del desmuntatge dels fusos. Els estats de fosforilació dels factors estabilitzadors i desestabilitzadors dels microtúbuls, així com els nucleadors de microtúbuls, són els reguladors clau de les seves activitats.[9] Per exemple, NuMA és una proteïna reticulant de l'extrem inferior i el substrat Cdk, la dissociació del qual es fa des del microtúbul, es afectat per la seva desfosforilació durant la telofase.[2] Un model general per al desmuntatge de fus en el rent és que els tres subprocessos funcionals superposats de desconnexió, desestabilització i despolimerització del fus són afectats principalment per l'APC/CCDH1, per les cinases específiques per a estabilitzar microtúbuls, i per les depolimerases de microtúbuls de l'extrem més llunyà, respectivament. Es coneix que aquests efectors estan molt ben conservats entre el rent i els eucariotes superiors. L'APC/CCDH1 té com a objectiu proteïnes associades a microtúbuls entre reticulacions (NuMA, Ase1, Cin1 i més). Aurora B (rent IpI1) fosforilasa el fus associat la proteïna estabilitzant EB1 (lrent Bim1), que després es dissocia des dels microtúbuls, i el desestabilitzador She1, que després s'associa amb els microtúbuls. La kinesina 8 (rent Kip3), una depolimerasa que depèn dels ATP, accelera la despolimerització de microtúbuls a l'extrem més llunyà. Es va demostrar que la interrupció simultània d'aquests mecanismes, però no d'alguns, resulta en una hiperestabilitat dramàtica del fus durant la telofase, cosa que suggereix un solapament funcional malgrat la diversitat dels mecanismes.[13] La reconstrucció de la membrana nuclearEls components principals de la membrana nuclear són una membrana doble, formada per complexos de porus nuclears i una làmina nuclear interna a la membrana nuclear interior. Aquests components es desfan durant la profase i la prometafase, i es reconstrueixen durant la telofase, quan la membrana nuclear es torna a formar a la superfície de les cromàtides germanes separades.[14][15] La membrana nuclear és fragmentada i parcialment absorbida pel reticle endoplasmàtic durant la prometafase, i l'agregació de la membrana nuclear interna (amb vesícules del reticle endoplasmàtic que contenen proteïnes) a la cromatina es produeix durant la telofase en una inversió d'aquest procés. Les vesícules formadores de la membrana s'agreguen directament a la superfície de la cromatina, on es fonen lateralment en una membrana contínua.[2] Es requereix del Ran-GTP per a un muntatge precoç de la membrana nuclear a la superfície dels cromosomes; allibera els components de la membrana capturats per la importina-β durant la mitosi primerenca. El Ran-GTP es localitza a prop dels cromosomes a través de la mitosi, però no desencadena la dissociació de proteïnes de la membrana nuclear des de la importina-β fins que els objectius del M-Cdk es desfosforilitzen en la telofase.[2] Aquests components de la membrana inclouen diversos components de porus nuclears, el més estudiat dels quals és la proteïna de bastida de porus nuclear ELYS, que pot reconèixer les regions d'ADN riques en parells de bases A:T (in vitro) i, per tant, poden unir-se directament a l'ADN.[16] No obstant això, els experiments amb extractes d'òvul de Xenopus han conclòs que l'ELYS no s'associa amb l'ADN nu i només s'uneix directament els dímers d'histona i nucleosomes.[17] Després d'enllaçar-se a la cromatina, l'ELYS recluta altres components de la bastida de porus nuclear i de les proteïnes dels porus transmembrals. El complex de porus nuclears s'assambla i s'integra a la membrana nuclear de forma organitzada, afegint consecutivament Nup107-160, POM121 i FG Nups.[18] Es debat si el mecanisme de reconstrucció de membrana nuclear implica el muntatge inicial de porus nuclears i el reclutament posterior de les vesícules de la membrana al voltant dels porus, o si la membrana nuclear es forma principalment a partir de cisternae del reticle endoplasmàtic esteses, precedents del muntatge dels porus nuclears:
La membrana s'allisa i s'expandeix tancant dins d'ella tot el conjunt de cromàtides. Probablement això es produeix a causa de la importació de làmines dels porus nuclears, que es pot conservar dins d'una membrana contínua. Les membranes nuclears dels extractes d'òvul de Xenopus no es van suavitzar quan es va inhibir la importació de la làmina nuclear, quedant arrugades i estretament lligades als cromosomes condensats.[22] Tanmateix, en el cas de l'expansió lateral des del reticle endoplasmàtic, la importació nuclear s'inicia abans de finalitzar el reassemblament de la membrana nuclear, donant lloc a un gradient de proteïna intra-nuclear temporal entre els aspectes distals i medials del nucli que es forma.[18] Les subunitats de làmines desmuntades en la profase s'activen i són capturades durant la mitosi. El muntatge de làmines es desencadena per la desfosforilació de la làmina (i, a més, per l'esterificació metílica dels residus de COOH de la làmina-B). La lamina B pot orientar-se a la cromatina fins a mitja anafase. Durant la telofase, quan es restableix la importació nuclear, la làmina-A entra al nucli reconstruït, però continua muntant lentament a la làmina perifèrica durant diverses hores durant tota la fase G1.[16] Els extractes d'òvul de Xenopus i les línies cel·lulars de càncer humà han estat els models principals utilitzats per a l'estudi de la reconstrucció de la membrana nuclear.[18] Els rents no tenen làmines; la seva membrana nuclear roman intacta durant tota la mitosi i la divisió nuclear es produeix durant la citoquinesi.[11][23] La decondensació dels cromosomesLa descondensació dels cromosomes (també coneguda com a relaxació o descompactació) per convertir-se en cromatina expandida és necessària per a que la cèl·lula reprengui els processos de la interfase, i es produeix paral·lelament al muntatge de la membrana nuclear durant la telofase en moltes eucariotes. La desfosforilació Cdk mediada per la xarxa de sortida de la mitosi (MEN, mitosis exit network) és necessària per a la descondensació cromosòmica.[2][5] En els vertebrats, la descondensació cromosòmica només s'inicia després de restablir la importació nuclear. Si s'evita el transport de làmines a través dels porus nuclears, els cromosomes es mantenen condensats després de la citoquinesi i les cèl·lules no assoleixen tornar a introduir la següent fase S (fase de síntesi).[16] En els mamífers, el permís de l'ADN per a la fase S (l'associació de la cromatina als múltiples factors proteics necessaris per a la seva replicació) també es produeix coincidint amb la maduració de la membrana nuclear durant la telofase tardana.[24][25] Això pot atribuir i proporcionar proves per a la restitució de la maquinària d'importació nuclear de localitzacions de proteïnes nuclears i citoplasmàtiques interfàsiques durant la telofase.
Referències
Bibliografia
Vegeu també
|