|
Klebsiella pneumoniae
Klebsiella pneumoniae (також Клебсієла пневмонії, раніше паличка Фрідлендера) — грам-негативна факультативно-анаеробна паличкоподібна бактерія. Її виділив у 1882 році німецький мікробіолог Карл Фрідлендер[en]. Ця бактерія є одним зі збудників уражень, подібних до поширеної пневмококової інфекції. Найчастіше перебігає як пневмонія і також асоційована з інфекціями сечостатевої системи та нозокоміальними інфекціями людини. Родову назву клебсієли, ця бактерія отримала на честь німецького бактеріолога Едвіна Клебса.[1] Біологічні властивостіМорфологіяK. pneumoniae — грам-негативна, дрібна (0,5-0,8 × 1-2 мікрон) паличкоподібна бактерія. Не утворює спор, нерухома. Здібна до утворення капсули. Розташовуються поодинці, попарно і скупченнями. Легко забарвлюються аніліновими фарбниками. Культуральні властивості K. pneumoniae — хемоорганогетеротроф, факультативний анаероб. Культивується на простих поживних середовищах (МПА, МПБ). На агаризованих поживних середовищах утворює круглі слизуваті сірувато-білі колонії. У МПБ — рівномірне помутніння середовища з утворенням тягучого слизуватого осаду і плівки. Зброджує лактозу, не утворює індолу. ПатогенністьK. pneumoniae є одним зі збудників пневмонії[2], а також інфекцій сечостатевої системи[3], гнійних абсцесів печінки[4][5], селезінки[6][7][8]. Спричинює гнійні плеврити, перикардити, гайморити, ендофтальміти. Важливий збудник внутрішньолікарняних інфекцій. Ці бактерії також патогенні для деяких тварин[9]. Деякі штами бактерії мають полірезистентність до багатьох антибіотиків, обумовлену наявністю R-плазміди, також деякі штами проявляють стійкість до карбапенемів внаслідок наявності карбапенем-гідролізуючих β-лактамаз[10]. Капсула, яку формують деякі штами бактерії, також є фактором патогенності[11]. Гіпервірулентна K. pneumoniaeГіпервірулентна K. pneumoniae — це досить новий різновид, який є значно вірулентнішим, аніж класичні штами. У той час як вони є умовно-патогенними збудниками внутрішньолікарняних інфекцій, які зазвичай уражають пацієнтів з ослабленим імунітетом, гіпервірулентна клебсієла породжує більше занепокоєння з клінічного погляду, оскільки вона також спричинює захворювання у здорових людей і може уражати практично будь-який орган чи систему.[12] Вона походить з Азії, та спричинює високу летальність. Вона часто поширюється на центральну нервову систему та очі, спричинюючи ендофтальміт, позапечінкові абсцеси, пневмонію, некротичний фасціїт та менінгіт. На початку 2024 року Глобальна система нагляду за резистентністю до антибактерійних препаратів (GLASS-EAR) надіслала запит на інформацію для оцінки поточної глобальної ситуації, враховуючи збільшення кількості ізолятів гіпервірулентного K. pneumoniae (hvKp) тип послідовності ST23 несуть гени стійкості до карбапенемових антибіотиків — гени карбапенемаз. Штами K. pneumoniae останніми роками виявлялися все частіше, вважаються гіпервірулентними порівняно з класичними штамами через їхню здатність інфікувати як здорових людей, так і осіб з ослабленим імунітетом, а також через їхню підвищену схильність до інвазивних інфекційних уражень. Про наявність таких штамів повідомлялося принаймні з однієї країни в усіх шести регіонах ВООЗ. Поява цих ізолятів із резистентністю до антибіотиків останньої лінії, таких як карбапенеми, вимагає призначення альтернативного антибактерійного лікування, яке може бути недоступним у багатьох контекстах і низці країн. ВООЗ рекомендує державам-членам поступово збільшувати свій лабораторний діагностичний потенціал для забезпечення ранньої та надійної ідентифікації гіпервірулентних штамів, а також зміцнювати лабораторні можливості для молекулярного тестування, виявлення та аналізу відповідних генів вірулентності на додаток до генів резистентності. Оцінка ризику на глобальному рівні є помірною, враховуючи проблеми з епідеміологічним наглядом, відсутність інформації про частоту лабораторних досліджень, шляхи та масштаби передачі інфекції серед населення, прогалину в доступних даних про хвороби, спричинені такими штамами, госпіталізацію та загальний тягар захворювання. Існує потреба у відкритті нових терапевтичних спрямувань, спрямованих не лише на лікування мультирезистентних уражень, але й на ті ураження, які спричинюють гіпервірулентні варіанти. Загалом 43 зі 124 країн, територій і районів шести регіонів ВООЗ надали відповіді: Африка (10); Європа (10); Східне Середземномор'я (10); Західна частина Тихого океану (6); Америка (4); Південно-Східна Азія (3). З них загалом 16 країн і територій повідомили про наявність гіпервірулентної K. pneumoniae, а 12 повідомили про наявність штаму ST23-K1.[13] Стійкі штами клебсієл Різні види роду Клебсієли часто стійкі до багатьох антибіотиків. Сучасні дані вказують на те, що плазміди є основним джерелом генів резистентності.[14] Види клебсієли зі здатністю продукувати бета-лактамази розширеного спектра дії стійкі практично до всіх бета-лактамних антибіотиків, крім карбапенемів. Також K. pneumoniae часто стійка до аміноглікозидів, фторхінолонів, тетрациклінів, хлорамфеніколу і сульфаметоксазол/триметоприму.[15] Ураження стійкими до карбапенемів ентеробактеріями або тими, які продукують карбапенемази, стає важливою проблемою в медичних закладах.[16][17] Однією з таких бактерій є стійка до карбапенемів K. pneumoniae. За останні 10 років у всьому світі спостерігалося поступове зростання кількості таких хвороб; однак цей новий внутрішньолікарняний патоген, ймовірно, найбільш відомий спалахом, який почався приблизно у 2006 році в системі охорони здоров'я Ізраїлю.[18] У США ураження полірезистентною K. pneumoniae вперше описано у Північній Кароліні в 1996 році; з того часу бактерію було виявлено в 41 штаті. Її регулярно виявляють в деяких лікарнях Нью-Йорка та Нью-Джерсі. Зараз це найпоширеніший вид стійких до карбапенемів ентеробактерій, який зустрічається в Сполучених Штатах. Резистентна до карбапенемів K. pneumoniae є стійкою майже до всіх наявних антибактерійних препаратів, а зараження нею спричиняє високий рівень захворюваності та летальності, особливо серед осіб, які тривалий час перебувають на стаціонарному лікуванні, а також серед тих, хто перебуває в критичному стані та піддається впливу інвазивних пристроїв (наприклад, апаратів штучної вентиляції легень або центральних венозних катетерів). Занепокоєння викликає те, що карбапенеми часто використовуються як крайній засіб у боротьбі зі стійкими штамами бактерій. Нові незначні мутації можуть призвести до виникнення таких хвороб, у лікуванні яких медичні працівники будуть безсилі щось зробити. Масштаби та поширеність стійкої до карбапенемів K. pneumoniae у довкіллі наразі невідомі. Рівень летальності також невідомий, але за деякими спостереженнями він досягає 44 %.[19] Центри з контролю та профілактики захворювань (CDC) випустили рекомендації щодо ретельного контролю інфекцій для боротьби зі стійкою до карбапенемів K. pneumoniae.[20] У 2019 році в усьому світі було зареєстровано 192 530 смертей, пов'язаних із резистентними штамами K. pneumoniae.[21] Місцеві спалахиЗагальнонаціональний спалах, спричинений стійкою до карбапенемів K. pneumoniae, в Ізраїлі сягнув піку в березні 2007 року і становив 55,5 випадків на 100 000 ліжко-днів, що призвело до необхідності загальнонаціонального плану протиепідемічних дій. Такі заходи передбачали фізичну ізоляцію всіх носіїв цієї бактерії, а також створення робочої групи для нагляду за ефективністю ізоляції шляхом ретельного моніторингу лікарень і втручання в разі потреби. Після впровадження плану (оцінка проводилась у травні 2008 року) кількість випадків на 100 000 ліжко-днів зменшилась до 11,7. План був дієвим завдяки суворому дотриманню лікарнями вимог, згідно з якими кожна з них повинна була вести детальну документацію про всіх носіїв цієї бактерії. Фактично, на кожне підвищення рівня комплаєнсу на 10 % кількість випадків на 100 000 ліжко-днів зменшувалася на 0,6.[22] У середині серпня 2016 року жителька округу Вошо була госпіталізована в Ріно через ураження стійкою до карбапенемів K. pneumoniae. На початку вересня того ж року у неї розвинувся септичний шок і вона померла. Під час тестування CDC ізолят від пацієнта виявився стійким до всіх 26 антибіотиків, доступних у США, включаючи препарат останньої надії колістин.[23] Вважається, що вона могла заразитися, перебуваючи в лікарні в Індії протягом двох років через зламану праву стегнову кістку.[24][25][26] Перенесення генів стійкості до антибактерійної терапії K. pneumoniae містить велику кількість генів стійкості до антибактерійної терапії. Ці гени передаються через плазміди від інших бактерійних збудників та до них. Одним з таких збудників, який зазвичай отримує гени стійкості до антибактерійної терапії від K. pneumoniae є представники роду Сальмонела. Механізми та шляхи передачі K. pneumoniae до людейВедучим механізмом передачі інфекції для K. pneumoniae є повітряно-крапельний. При цьому збудник потрапляє в дихальну систему, спричиняючи пневмонію. Звідти можливе потрапляння в кров, що призводить до ураження інших органів і систем. У медичних закладах K. pneumoniae можуть передаватися від людини до людини через забруднені руки медичного персоналу або інших людей від пацієнта до пацієнта, або, рідше, через забруднення навколишнього середовища; роль передачі безпосередньо від навколишнього середовища пацієнтам є суперечливою та потребує подальшого дослідження.[28] Пацієнти в медичних закладах також можуть заражатися K. pneumoniae, коли вони знаходяться на апаратах штучної вентиляції легенів (передавання здійснюється через забруднені, погано дезинфіковані дихальні контури апаратів) або мають внутрішньовенні катетери чи рани (тоді передача відбувається завдяки гемоконтактному механізму передачі інфекції або контактному). Ці медичні засоби та умови можуть дати змогу K. pneumoniae потрапити в організм і спричинити хворобу.[29] Лікування уражень, спричинених K. pneumoniaeУраження, спричинені K. pneumoniae, важко лікувати, оскільки проти них дієвий менший набір антибіотиків. У таких випадках мікробіологічна лабораторія повинна провести тести, щоб визначити, які антибіотики будуть діяти на цього збудника[29] Лікування уражень, спричинених Klebsiella pneumoniae, здійснюється аміноглікозидами, піперациліном і цефалоспоринами, — вибір залежить від тесту на чутливість до антибіотиків, стану здоров'я людини, хвороби та її тяжкості.[30][31] 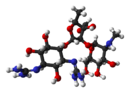  K. pneumoniae містить бета-лактамазу, що робить її стійкою до ампіциліну. Багато штамів набули бета-лактамази розширеного спектра дії з додатковою стійкістю до карбеніциліну, амоксициліну та цефтазидиму. Ці бактерії залишаються чутливими до аміноглікозидів і деяких цефалоспоринів, і повідомлялося про деякий ступінь інгібування бета-лактамази клавулановою кислотою. Ураження, спричинені мультирезистентними грамнегативними бактеріями у відділеннях реанімації, зумовили необхідність використання колістину . Однак там повідомлялося про стійкі до колістину штами K. pneumoniae.[32][33][34][35] У 2009 році в Індії та Пакистані були виявлені штами K. pneumoniae з геном ферменту під назвою «Нью-Делійська метало-бета-лактамаза» (NDM-1), що мала стійкість навіть проти внутрішньовенних карбапенемів. Випадки уражень, спричинених K. pneumoniae на Тайвані, показали аномальну патогенність, спричинюючи абсцеси печінки у людей з цукровим діабетом; лікування полягало в застосуванні цефалоспоринів третього покоління. Для інфекцій сечових шляхів, спричинених мультирезистентною K. pneumoniae, запропоновано комбіновану терапію амікацином і меропенемом.[36] ВакциниВ Україні зареєстровано декілька вакцин проти K. pneumoniae: бронхо-мунал, лантіген Б, ісміжен, бронхо-ваксом, респіброн та інші. Розроблена вакцина «Клепро-Примавак».[37] Профілактика внутрішньолікарняної передачі K. pneumoniaeЩоб запобігти поширенню K. pneumoniae в медичних закладах, персонал повинен дотримуватися спеціальних заходів інфекційного контролю[29], які можуть включати суворе дотримання гігієни рук (бажано використовувати спиртовий засіб для протирання рук (60–90 %) або мило та воду, якщо руки помітно забруднені. Засоби для протирання рук на спиртовій основі дієві проти цих грамнегативних бактерій[38], також медичний персонал має надягати халати та рукавички, коли вони входять у приміщення чи палати, де знаходяться пацієнти із захворюваннями, пов'язаними з K. pneumoniae. Заклади охорони здоров'я також повинні дотримуватися суворих процедур дезінфекції, щоб запобігти поширенню K. pneumoniae.[29] Щоб запобігти поширенню K. pneumoniae, пацієнти також повинні дуже часто мити руки, зокрема:
Дослідження бактеріофагів, які знищують K. pneumoniaeКілька резистентних штамів K. pneumoniae знищувалися in vivo шляхом внутрішньочеревного, внутрішньовенного або інтраназального введення бактеріофагів під час лабораторних досліджень експериментальної інфекції у лабораторних тварин.[39] Також бактеріофаги успішно використовувалися для припинення спалахів внутрішньолікарняних інфекцій.[40] Резистентність до бактеріофагів навряд чи буде такою проблемою, як до антибіотиків, оскільки нові бактеріофаги, ймовірно, будуть доступні в навколишніх осередках. Фаготерапія може використовуватися в поєднанні з антибіотиками, щоб доповнити їхню дію, але не замінити її повністю.[41][42][43] В Україні зареєстрований та виробляється препарат «Поліфаг Ультра»; до складу цього препарату входять специфічні бактеріофаги до K. pneumoniae.[44][45] Див. такожПримітки
Посилання
|
