|
Органічні сполуки
 Органі́чні сполу́ки — клас хімічних сполук, основу яких складає хімічний елемент вуглець в збудженому стані (явище переходу електронів на вищі енергетичні рівні за розпаду заповненої комірки на нижчому енергетичному рівні), коли його максимальна валентність дорівнює IV, а не II (за спокійного стану). Окрім вуглецю органічні сполуки майже завжди містять водень, досить часто — кисень, азот та галогени, рідше фосфор, сірку та інші елементи. Винятком є карбіди, карбонатна кислота і карбонати, оксиди вуглецю і ціаніди. Органічні сполуки є основою майже усіх природних речовин, які отримуються під час розвитку рослин, або внаслідок життєдіяльності тварин. Вітаміни, білки і гормони — всі вони належать до ряду органічних сполук або складаються з них. Окрім цього велика кількість нових органічних сполук щороку синтезується в лабораторіях. Загальна характеристика Термін «органічний» щодо речовин, типових для живої природи (як-от цукор, жири, деревина тощо), запропонував 1807 року Єнс Якоб Берцеліус. Тоді помилково вважалося, що органічні сполуки можуть утворюватися тільки в живих організмах. Можливість перетворення неорганічних речовин на органічні була доведена 1829 року, коли німецький хімік Фрідріх Велер зумів отримати «органічну» сечовину з «неорганічного» ціанату амонію[1]. Зараз більшість органічних сполук отримують штучним шляхом і науковцям вже відомо понад 9 мільйонів органічних сполук[2]. Чіткої межі між органічними та неорганічними сполуками не існує. Наприклад, мурашина кислота (перший представник карбонових кислот) є органічною, проте її ангідрид, монооксид вуглецю, є неорганічним. БудоваДо складу органічних молекул органічних речовин поряд із вуглецем входять деякі хімічні елементи. Це насамперед водень, кисень, азот, сірка, галогени і фосфор. Подеколи вуглець утворює зв'язки і з атомами металів — такі сполуки дістали назву металоорганічні (до їхнього числа не відносяться карбіди, ацетиленіди та аналогічні сполуки). Однією з важливих особливостей органічних сполук, яка накладає відбиток на всю хімічну поведінку, є характер зв'язків між атомами в їхніх молекулах. У переважній більшості випадків ці зв'язки мають яскраво виражений ковалентний характер. Оскільки атом C має чотири неспарені електрони, то відповідно він утворює в органічних сполуках чотири ковалентні зв'язки. При їхньому утворенні відбувається гібридизація атомних орбіталей, залежно від типу взаємодії між атомами вуглецю. Так, для атома вуглецю відомі стани гібридизації sp3, sp2 та sp, що умовно відповідають одинарному, подвійному та потрійному зв'язках між атомами вуглецю:
Окрім ковалентних зв'язків у молекулах органічних сполук також може зустрічатися йонний зв'язок. Однак він не характерний для власне вуглецю, тому його утворюють інші елементи: кисень, водень, азот тощо. Також між молекулами (а інколи і всередині них) можливе утворення водневих зв'язків. Одним із найпоширеніших прикладів такого зв'язку можна назвати взаємодію між азотистими основами, що утворюють ДНК.   Проте на відміну від неорганічних сполук, молекулярна формула органічної сполуки ще не дає уявлення про її властивості. Відомо дуже багато органічних сполук, які мають однаковий склад і однакову молекулярною масу, але абсолютно різні фізичні і навіть хімічні властивості. Це явище пояснюється здатністю вуглецю утворювати розгалужені структури. Можливість утворити одразу декілька варіантів структур виходячи з тієї ж кількості атомів суттєво збільшує розмаїття органічних сполук, значно перевершуючи в цьому неорганічні, навіть з огляду на значно меншу кількість використовуваних хімічних елементів. Це явище дістало назву ізомерія, а речовини, що відповідають тій самій молекулярній формулі, але відрізняються за своїми властивостями, називаються ізомерами. Пояснення різних випадків ізомерії дає теорія будови органічних сполук, створена в шістдесятих роках позаминулого сторіччя Олександром Бутлеровим, згідно з якою властивості речовин визначаються не тільки їх якісним і кількісним складом, як вважали раніше, але і внутрішньою будовою молекул, певним порядком з'єднаних між собою атомів, які утворюють молекулу. Цей внутрішній устрій Бутлеров назвав «хімічною будовою». Особливо важливою була ідея Бутлерова про те, що атоми, з'єднуючись хімічно в певній послідовності відповідно до їхньої валентності, взаємно впливають один на одного таким чином, що частково змінюється їх власна природа, їх «хімічний зміст». Вчення Бутлерова про хімічну будову молекул складають теоретичну основу органічної хімії. Хімічні властивостіОскільки органічні сполуки утворені переважно ковалентними зв'язками, то вони, як правило, не дисоціюють на йони і порівняно повільно взаємодіють один з одним. В той час як реакції між електролітами в розчинах протікають майже миттєво, час, необхідний для завершення тієї або іншої реакції між органічними речовинами, зазвичай вимірюється годинами, а іноді і днями. От чому в органічній хімії велике значення має застосування різних каталізаторів. Інша характерна риса органічних сполук полягає в їхній схильності піддаватися при нагріванні без доступу повітря глибоким змінам, в результаті котрих утворюються нові речовини, які мають абсолютно інші властивості. Якщо ж вести нагрівання при доступі повітря або у присутності окисників, то органічні речовини згорають, причому вуглець і водень, що входять до їх складу цілком перетворюються на двоокис вуглецю і воду, а азот зазвичай виділяється у вільному стані в повітря. На цьому заснований елементний аналіз органічних речовин: вміст вуглецю і водню в згорілій речовині визначають за кількістю двоокису вуглецю і води, які утворилися, азот, що виділився, вимірюють безпосередньо, а вміст кисню встановлюють за різницею між вагою згорілої речовини і вагою решти елементів, що містилися в ньому. Дані аналізу і визначення молекулярної ваги дозволяють вивести молекулярну формулу органічної речовини. КласифікаціяСучасна класифікація органічних сполук ґрунтується на наступних положеннях:
Відповідно до будови вуглецевого ланцюга всі органічні сполуки підрозділяються на три великі групи.
При класифікації органічних сполук за основні речовини беруться речовини, що належать до класу вуглеводнів, тобто сполуки, що складаються тільки з вуглецю і водню. Всю решту сполук розглядають як похідні з вуглеводнів шляхом заміни в їхніх молекулах частини або всіх атомів водню іншими атомами або атомними групами. Групи атомів, які обумовлюють загальні хімічні властивості речовин, що належать до одного і того ж класу, називаються функціональними групами. Якщо в молекулі речовини є декілька різних функціональних груп, то така речовина називається сполукою зі змішаними функціями. Номенклатура органічних сполук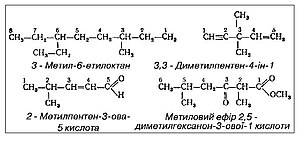 Для найменування окремих органічних сполук користуються різними номенклатурними системами. Широко застосовуються льєзькі правила і номенклатура IUPAC. Поширені тривіальна, раціональна і женевська системи номенклатури. За найстарішою, тривіальною номенклатурою назви органічних сполук мають випадковий характер, наприклад: болотяний газ, мурашиний альдегід, бурштинова кислота і т. д. Такі назви не дають уявлення про будову сполук, і тому тривіальна система не задовольняє вимог теорії і практики органічної хімії. Раціональна і женевська номенклатури засновані на принципах наукової систематики органічних сполук: назва речовини дається відповідно до її хімічної будови. За раціональною номенклатурою в основу найменувань органічних речовин покладені назви найпростіших (перших) сполук того або іншого гомологічного ряду. Складніші сполуки розглядають як похідні найпростіших, в яких атоми водню заміщені замісниками. Згідно з женевською номенклатурою основою найменування є назва нормального вуглеводню, що містить те ж число атомів вуглецю, що і найдовший (або найскладніший) безперервний ланцюг вуглецевих атомів у даній сполуці. Початок нумерації головного ланцюга визначається передусім вуглеводневими замісниками, назви яких ставлять перед коренем слова. У разі однакового положення двох замісників перевага віддається замісникові з меншим числом атомів вуглеводню. Кратні зв'язки, що позначаються закінченням -ен або суфіксом -ен- (подвійний зв'язок) або -ин(ін) (потрійний зв'язок) замість -ан у насиченого вуглеводню, займають друге місце при визначенні порядку нумерації, причому перевага надається потрійному зв'язку. Наступні місця належать функціональним кисневим або сірчаним групам і азотним групам, позначення яких відповідно ставляться в кінці слова і перед назвою вуглеводневих замісників. Останнє за значенням місце при визначенні початку нумерації належить нефункціональним замісникам (галогенам, нітрозо-, нітро-, азидогрупам), позначення яких ставлять на самому початку назви органічної сполуки. Порядок розташування назв нефункціональних замісників зворотний до їх старшинства при визначенні нумерації. Цифрами позначають положення бічних ланцюгів, груп або кратних зв'язків у головному вуглеводневому ланцюгу; грецькими (іноді латинськими) числівниками — число однакових замінних груп або кратних зв'язків. Приклади: При найменуванні сполук із замкненим ланцюгом атомів загальні принципи женевської номенклатури залишаються незмінними, але є ряд особливостей. Див. такожПримітки
ПосиланняДжерела
Література
|
||||||||


