|
IsomerisatieIsomerisatie is een chemische reactie waarbij het hoofdproduct een isomeer is van de belangrijkste reactant.[1] Bij isomerisatie verandert de ruimtelijke ordening van moleculaire groepen. Dergelijke reacties zijn vooral belangrijk bij organische verbindingen, als gevolg van het voorkomen van meer reactieve verbindingen en atomen in vergelijking met anorganische verbindingen: zie bijvoorbeeld koolstof-koolstof dubbele bindingen, carbonylgroepen en bijvoorbeeld imines. Hierdoor ontstaan bijvoorbeeld diastereomeren of enantiomeren. Isomerisaties kunnen eenstaps of meerstaps zijn, al dan niet gekatalyseerd. Een intramoleculaire isomerisatie waarbij bindingen worden gemaakt of verbroken is een bijzonder geval van omlegging. Omlegging valt niet noodzakelijkerwijs onder isomerisatie. Soorten isomerisatiereactiesRacemisatieRacemisatie is een isomerisatiereactie waarbij uitgaande van één bepaald isomeer, een mengsel van isomeren (enantiomeren of diastereomeren) bekomen wordt. De samenstelling van dit mengsel wordt bepaald door het thermodynamisch evenwicht. Resolutie is het scheiden van een racemisch mengsel in zijn componenten. Piramidale inversiePiramidale inversie wordt gekarakteriseerd door de aanwezigheid van een niet gebonden elektronenpaar aan een sp3 gehybridiseerd atoom. Een dergelijke situatie komt voor bij aminen, fosfinen en bepaalde zwavelverbindingen. Gedurende de inversie gaat het sp3 gehybridiseerd atoom over naar een sp2 hybridisatie met het vrije elektron in het ontstane p-orbitaal. Volgens de ValentieSchilElectronenPaarRepulsie theorie (kortweg VSEPR) is dit niet voordelig en kost deze overgang naar de sp2-toestand energie. Deze energie komt terug vrij bij het omklappen. De geometrieën van de isomeren verhouden zich als beeld en spiegelbeeld.
In-vlakinversieIn-vlakinversie aan sp2 gehybridiseerd stikstofatoom. Deze inversie is analoog aan de piramidale inversie met een sp-hybridisatie in de transitiestoestand.
Gekatalyseerde isomerisatiesGekatalyseerde isomerisaties zijn altijd meerstapsreacties, waarbij vertrekkend van één isomeer dikwijls verschillende isomeren kunnen ontstaan. De evenwichtsconcentraties zijn afhankelijk van de energie-inhoud of ook de vormingsenthalpie van de betrokken producten. Dergelijke isomerisaties zijn vaak ongewenst bij de (stereoselectieve) organische synthese. Bijvoorbeeld:
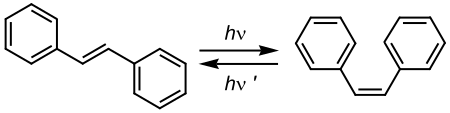
Enzymatische isomerisatieEnzymen zijn eiwitten of proteïnen die uitermate geschikt zijn om reacties (en dus ook isomerisaties) te katalyseren. Ze versnellen reacties in levende wezens door via een alternatief reactiemechanisme de activeringsenergie te verlagen. Vaak ontstaat in biologisch opeenvolgende reacties ofwel een racemisch mengsel ofwel een zuiver isomeer dat niet onmiddellijk bruikbaar is. Indien enzymen isomerisaties niet konden katalyseren zou in deze gevallen respectievelijk de helft of de volledige hoeveelheid product onbruikbaar zijn. Enzymen verhogen als dusdanig de efficiëntie van het materiaalgebruik in bio-organismen. Licht-geïnduceerde isomerisatieSommige licht-geïnduceerde isomerisaties zijn atypische vormen van isomerisatiereacties. Voorbeelden van deze categorie isomerisaties is de cis-trans conversie van alkenen. Bij deze radicaalreactie wordt een foton opgenomen waarbij de dubbele binding in een geëxciteerde toestand terechtkomt. Vanuit deze transitietoestand kan de molecule met evenveel kans relaxeren naar de cis- of transvorm. Beide vormen hebben een ander absorptiespectrum, en indien men een golflengte kan kiezen die door de ene vorm geabsorbeerd wordt en niet door de andere, dan kan men het volledige startproduct omzetten in de andere vorm. Indien zo een golflengte niet kan gekozen worden wordt een evenwichtstoestand bekomen. Zie ook het voorbeeld van de omzetting van trans-stilbeen in cis-stilbeen:
Deze reactie wordt onder andere gebruikt voor het licht-geïnduceerd aanmaken van fenantreen met cyclohexaan als oplosmiddel. Gesubstitueerd stilbeen geeft dan aanleiding tot gesubstitueerde fenantrenen. Herkennen van isomerisatiesIsomerisaties brengen een aantal veranderingen in eigenschappen met zich mee. Zo nemen de ontstane isomeren elk met een verschillende snelheid deel aan de erop volgende scheikundige reacties. Bovendien zullen enantiomeren vaak bij uitkristallisatie kristallen vormen elkaars spiegelbeeld zijn. Isomerisaties herkent men experimenteel bijvoorbeeld met de volgende technieken:
Energetische aspectenDe Gibbs vrije energie of energie-inhoud van isomeren is veelal gelijk of ruwweg gelijk. Daardoor komen de betrokken isomeren dikwijls in ongeveer gelijke percentages (percentages volgens de Boltzmann-verdeling) voor:
met:
De formule van Arrhenius geeft het verband van de reactiesnelheid met de temperatuur: met:
Wanneer de activeringsenergie dus laag is, zijn isomeren gemakkelijk in elkaar om te zetten. Stereoisomeren die in elkaar eenvoudig omgezet kunnen worden door rotatie rond een binding, noemt men conformatie-isomeren. Stereoisomeren die niet eenvoudig in elkaar om te zetten zijn door een simpele rotatie (hetzij door de activeringsenergie, hetzij doordat groepen een andere bindingsplaats hebben), noemt men configuratie-isomeren. Dus, naargelang de isomerisatie zeer snel ( < 100 kJ/mol) of traag ( > 100 kJ/mol) gebeurt spreekt men respectievelijk van conformatie-isomeren (of conformaties, conformeren) en configuraties. Daarom komt bij sommige moleculen isomerisatie spontaan voor bij kamertemperatuur. Is de activatie-energie echter hoog, dus een trage isomerisatie bij kamertemperatuur, dan kan men de producten als afzonderlijk beschouwen en herkennen. Deze producten hebben een andere ruimtelijke ordening van hun moleculaire groepen, en men noemt de beide structuren dan ook stereoisomeren. Voorbeelden:
Belang van isomerisatiesIemand die betrokken is bij spectroscopie, analytische chemie of organische synthese dient zich altijd bewust te zijn van mogelijke isomerisatie. Soms heeft dit totaal geen belang. In andere gevallen is isomerisatie eerder nadelig, zoals in bijvoorbeeld de stereoselectieve synthese: in dit geval gaat de waarde van het geproduceerde goed verloren door isomerisatie. In dit geval moeten de uitgevoerde synthesestappen zo gekozen worden dat verdere reacties de reeds uitgevoerde stappen niet nutteloos maken. Zie hierbij ook: convergente synthese, katalyse en beschermende groepen. In weer andere gevallen is isomerisatie dan weer uiterst gevaarlijk zoals gebleken is bij het geneesmiddel softenon. Daar waar het isomeer farmaceutisch actief is, is het andere isomeer teratogeen. In nog andere gevallen is isomerisatie dan weer gewenst, om een zo hoog mogelijk rendement te bekomen. In organismen wordt zo op sommige ogenblikken veel van 1 isomeer gebruikt, terwijl op andere momenten of in andere cellen wellicht een overmaat van een ander isomeer verbruikt wordt. Zie bijvoorbeeld glucose in planten: dit wordt zowel gebruikt voor het leveren van energie in de Krebs-cyclus, als voor de productie van zetmeel (gemaakt uit α-D-glucose) en voor de productie van cellulose (gemaakt van β-D-glucose) in (wellicht) weer andere cellen. Ten slotte vindt isomerisatie een toepassing bij de grootschalige productie van benzine. Het octaangetal van de benzine wordt verhoogd door lineaire koolwaterstoffen met een laag octaangetal om te zetten naar vertakte isomeren met een hoog octaangetal. Zie ook
Bronnen, noten en/of referenties
|