|
Appelzuur
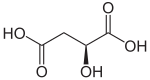
Appelzuur is een zwak organisch zuur, met de systematische naam 2-hydroxybutaandizuur, dat een onderdeel is van de citroenzuurcyclus en verder onder meer in appels voorkomt (het zorgt voor de zure smaak van groene appels). Het maakt, samen met onder andere wijnsteenzuur, deel uit van de tweewaardige hydroxycarbonzuren. Appelzuur staat als E296 op de lijst van E-nummers. In de (bio)medische wetenschappen wordt appelzuur vaak aangeduid als malaat, de naam voor de zouten en esters van appelzuur, omdat onder de omstandigheden waaaronder in die wetenschapsgebieden de stof wordt aangetroffen (pH is onfgeveer 7), beide zuurgroepen hun proton hebben afgestaan, en dus het dianion, het malaat, aanwezig is. Synthese van appelzuurAppelzuur en de zouten van appelzuur, de zogenaamde malaten worden langs chemische weg gemaakt uit fumaarzuur of via biochemische processen door bacteriën en schimmels. Bekende zouten zijn natriummalaat (E350), kaliummalaat (E351) en calciummalaat (E352). Stereo-isomerenEr bestaan twee stereo-isomeren van appelzuur, appelzuur L en appelzuur D, doordat het één asymmetrisch koolstofatoom heeft: het derde koolstofatoom in de structuurformules. Appelzuur in de citroenzuurcyclusIn de citroenzuurcyclus is appelzuur de stof tussen het onverzadigde fumaraat en het α-ketozuur oxaalazijnzuur.
Appelzuur en fotosyntheseVooral succulente planten kunnen 's nachts, als de huidmondjes openstaan, CO2 opnemen en vastleggen als appelzuur. Overdag als de zon schijnt kunnen zij dan met gesloten huidmondjes, om verdamping zo veel mogelijk te beperken, appelzuur weer afbreken en fotosynthese uitvoeren. Zie verder Crassulacean Acid Metabolism. ToepassingenHet wordt als zuivere stof vooral in levensmiddelen gebruikt onder het label E 296, maar er zijn ook verschillende verbindingen van appelzuur in de chemische industrie. In cosmetica komt het soms voor in plaats van citroenzuur. Appelzuur wordt onder andere voor het volgende gebruikt:
 Bronnen, noten en/of referenties
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||





![{\displaystyle {\ce {->[{\ce {fumaraathyratase}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aa5670de370e0430ae03792b28a7e16420a85fea)

![{\displaystyle {\ce {->[{\ce {malaatoxidase}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/79a781a8855c16cdb9f2d02e8bdc50c717981718)
