|
尿酸オキシダーゼ
尿酸オキシダーゼ(urate oxidase)または尿酸酸化酵素(にょうさんさんかこうそ)は、次の化学反応を触媒する酸化還元酵素である。
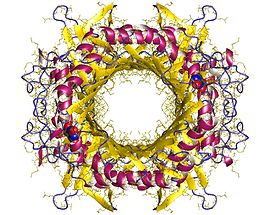
これらのうち5-ヒドロキシイソ尿酸は比較的不安定な物質であり、非酵素的に脱炭酸してアラントインとなる。 構造尿酸オキシダーゼは等しい4個のサブユニットからなるホモ四量体酵素で、それぞれの接合部分に計4ヶ所の活性部位がある。アスペルギルス・フラバスの尿酸オキシダーゼは301のアミノ酸残基からなり、その分子量は33,438Daである。酸化酵素としては珍しく、金属イオンや有機補因子を持たない。 ヒトでの重要性尿酸オキシダーゼはバクテリアから哺乳類に至るまで広範囲で見られ、その代謝的役割はその有機体の種類に依存する。しかし、ヒトでは尿酸オキシダーゼのための遺伝子を持っているにもかかわらず機能はしていない。これは霊長類のヒト上科への進化の過程における突然変異が原因とされている。ゆえに、尿酸はヒトのプリン異化の最終生成物となっている。一方で、尿酸は強力な抗酸化物質であり、尿酸オキシダーゼタンパク質発現の欠損はヒト科の動物にとって有利であったとの考え方もある[1]。 霊長類の進化は約6500万年前、白亜紀末期頃に始まったと考えられている[2]。霊長目でL-グロノラクトンオキシダーゼ(ビタミンC合成酵素)の活性が失われたのは約6300万年前であり、直鼻猿亜目(酵素活性なし)と曲鼻猿亜目(酵素活性あり)の分岐が起こったのとほぼ同時である。ビタミンC合成能力を失った直鼻猿亜目にはメガネザル下目や真猿下目(サル、類人猿、ヒト)を含んでいる。ビタミンC合成能力を有する曲鼻猿亜目には、キツネザルなどが含まれる[3]。 霊長類の狭鼻下目であるヒト上科がオナガザル上科から分岐したのは、2800万年から2400万年前頃であると推定されている[4][5]。5種のヒト上科(テナガザル、オランウータン、チンパンジー、ゴリラ、ヒト)の肝臓から尿酸オキシダーゼ活性は検出されなかったが、ヒト上科以外の旧世界のサルと新世界のサルでは尿酸オキシダーゼ活性が検出された。ヒト上科の共通の祖先が旧世界のサルから分枝した際に、尿酸オキシダーゼ活性が消失したものと推定される[6]。尿酸オキシダーゼ活性の消失の意味付けは、尿酸が抗酸化物質として部分的にビタミンCの代用となるためである[7]。しかし、ヒトを含むヒト上科では、尿酸オキシダーゼ活性の消失により難溶性物質である尿酸が最終代謝産物となってしまう。より水溶性の高いアラントインへの反応は、一部の尿酸が体内で発生した活性酸素種によって非酵素的に進む程度である[8]。なお、尿酸は体内に存在することで活性酸素種によって自身は酸化されるという形で抗酸化物質として作用する一方で、尿酸が体内に異常蓄積すると水への溶解度が低いことから比較的容易に析出して結晶化し痛風発作を誘発する。 ヒト上科以外の生物での活性の喪失鳥類、陸生爬虫類、円口類、双翅目以外の昆虫、環形動物などの系統学的に無関係な生物で尿酸オキシダーゼの活性が喪失している[9]。 脚注
関連項目 |
||||||||||||||||||||