|
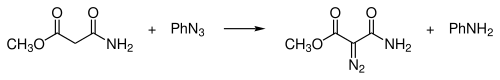
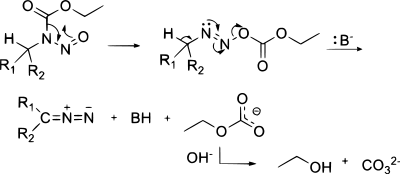
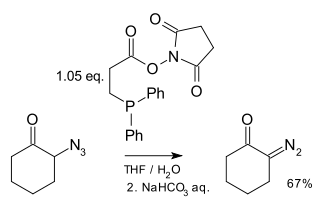
Diazosloučeniny Diazosloučeniny jsou organické sloučeniny obsahující diazoskupinu (=N+=N−) vázanou na uhlíkový atom, obecný vzorec je R-(C=N2)-R'. Nejjednodušší takovou sloučeninou je diazomethan. Elektronová struktura těchto sloučenin se skládá z kladného náboje na centrálním dusíkovém atomu a záporného náboje distribuovaného mezi koncovým dusíkem a uhlíkem, na nějž jsou tyto dusíky navázány. K nejstabilnějším diazosloučeninám patří α-diazo-ß-diketony a α-diazo-ß-diestery, a to díky delokalizaci záporného náboje v karbonylových skupinách; většina alkyldiazosloučenin patří mezi výbušniny. Skupinou izomerních sloučenin, které však nemají mnoho podobných vlastností, jsou diaziriny, u nichž jsou uhlík a dva dusíky propojené v cyklickém řetězci. Diazosloučeniny existují ve čtyřech rezonančních strukturách:[1] HistoriePrvní diazosloučeniny připravil roku 1858 německý chemik Peter Griess, když objevil novou všestrannou reakci.[2][3] PřípravaJe známo několik laboratorních postupů na přípravu diazosloučenin.[4] Z aminůAlfa akceptory substituované primární alifatické aminy R-CH2-NH2 (R = COOR, CN, CHO, COR) reagují s kyselinou dusitou za vzniku diazosloučenin. Z diazomethylových sloučeninPříkladem elektrofilní substituce za použití diazomethylové sloučeniny je reakce acylhalogenidu s diazomethanem.[5], jenž je mimo jiné prvním krokem v Arndt-Eistertově syntéze. Diazo přesunemPři diazo přesunu reagují některé karbonové kyseliny s tosylazidem: Tato reakce se také nazývá Regitzův diazo přesun.[6] Dalšími příklady jsou syntéza terc-butyldiazoacetátu[7] a di-terc-butyldiazomalonátu.[8] Z N-alkyl-N-nitrososloučeninDiazosloučeniny lze získat eliminační reakcí N-alkyl-N-nitrososloučenin,[9] jako například při přípravě diazomethanu z diazaldu nebo MNNG: Z hydrazonůDiazosloučeniny se dají připravit také z hydrazonů. Hydrazony se oxidují (vlastně dehydrogenují), například oxidem stříbrným; příkladem může být příprava 2-diazopropanu z acetonhydrazonu.[10] Jako oxidační činidlo lze použít rovněž octan olovičitý, oxid manganičitý nebo Swernovo činidlo. Při syntéze krotyldiazoacetátu reagují tosylhydrazony (obecný vzorec RRC=N-NHTs) se zásadou jako je například triethylamin.[11] Reakcí karbonylových sloučenin s derivátem hydrazinu 1,2-bis(terc-butyldimethylsilyl)hydrazinem vzniká hydrazom; ten se následně působením difluorjodbenzenu mění na diazosloučeninu:[12][13] Příprava fragmentací1,3-disubstituované alkylaryltriazeny mohou být fragmentovány za tvorby diazosloučenin. Tyto triazeny (ArN=NNH-CH2R) lze připravit spárováním diazoniových solí s primárními aminy. Z azidůByl popsán způsob pžípravy diazosloučenin z azidů za použití derivátů fosfanu.[14] ReakceCykloadiceDiazosloučeniny se využívají k diazoalkanovým 1,3-dipolárním cykloadicím, kde reagují jako 1,3-dipóly. Tvorba karbenůDiazosloučeniny se používají jako prekurzory karbenů, jenžt se získávají jejich termolýzou a nebo fotolýzou, například ve Wolffově přesmyku. Některé se mohou spárovat a vytvořit alkeny karbenovou dimerizací. Diazosloučeniny jsou meziprodukty Bamfordovy-Stevensovy reakce, při níž se přeměňují tosylhydrazony na alkeny, i zde vzniká karbenový meziprodukt: Jako nukleofilyBuchnerovou-Curtiusovou-Schlotterbeckovou reakcí se utváří ketony z aldehydů a alifatických diazosloučenin: Tato reakce patří mezi nukleofilní adice. OstatníV Doyleově-Kirmseově reakci reagují určité diazosloučeniny s allylsulfidy za vzniku homoallylsulfidů. Diazosloučeniny se také používají při cyklopropanacích, například při reakci ethyldiazoacetátu se styrenem.[15] Vnitromolekulárními reakcemi diazokarbonylových sloučenin vznikají cyklopropany. Při Buchnerově rozšíření cyklu reagují diazosloučeniny s aromatickými cykly, přičemž se tyto cykly rozšiřují. Výskyt v příroděDiazoskupinu obsahují dvě skupiny přírodních sloučenin: kinamycin a lomaiviticin. Tyto látky fungují jako DNA interkalátory. Reduktivně indukovanou ztrátou N2 dochází ke vzniku fluorenylového radikálu, který štěpí DNA. OdkazySouvisející článkyExterní odkazy
ReferenceV tomto článku byl použit překlad textu z článku Diazo na anglické Wikipedii.
|