|
Virus
Un virus és un agent infecciós submicroscòpic que només es pot replicar a l'interior de les cèl·lules d'un organisme hoste.[1] Els virus infecten tota mena d'éssers vius, des dels animals i les plantes fins als microorganismes, incloent-hi els bacteris i els arqueus.[2] Des de l'article del 1892 de Dimitri Ivanovski que donava compte d'un patogen no bacterià que infectava les plantes del tabac, seguit pel descobriment del virus del mosaic del tabac per Martinus Beijerinck el 1898,[3] s'han descrit més de 6.000 espècies de virus[4] dels milions que existeixen.[5] Els virus es troben en gairebé tots els ecosistemes del planeta i són l'entitat biològica més nombrosa de la Terra.[6] L'estudi dels virus rep el nom de virologia i és una branca de la microbiologia. Els virus es reprodueixen infectant cèl·lules hoste i obligant-les a fabricar milers de còpies de si mateixos a un ritme molt alt. Quan no es troben a l'interior d'una cèl·lula infectada o estan en curs d'infectar-ne una, els virus existeixen en forma de partícules independents que es coneixen com a virions i es componen de diverses parts: (i) el material genètic, és a dir, molècules llargues d'ADN o ARN que codifiquen les proteïnes que utilitza el virus; (ii) la càpsida, una capa proteica que envolta i protegeix el material genètic; i, en alguns casos, (iii), un embolcall víric extern format per lípids. Aquestes partícules víriques poden tenir una forma helicoidal o icosaèdrica simple o una estructura més complexa. Els virions de la majoria de les espècies no es poden veure ni amb un microscopi òptic, car són cent vegades més petits que la majoria dels bacteris. No es coneixen amb certesa els orígens dels virus en la història evolutiva de la vida. Alguns podrien haver evolucionat a partir de plasmidis (elements d'ADN que es mouen entre cèl·lules), mentre que d'altres podrien ser el resultat de la regressió de bacteris. En l'evolució, els virus són un mecanisme important de transferència horitzontal de gens, fenomen que augmenta la diversitat genètica de manera similar a com ho fa la reproducció sexual.[7] Alguns biòlegs veuen els virus com una forma de vida perquè són portadors de material genètic, es reprodueixen i evolucionen per selecció natural, tot i que manquen de diverses característiques fonamentals que se solen considerar indispensables per a la vida, com ara una estructura cel·lular. Com que tan sols presenten alguns dels trets propis de la vida, han estat descrits com a «organismes al límit de la vida»[8] i com a autoduplicadors.[9] Els virus es poden encomanar de moltes maneres. Per exemple, hi ha organismes que es coneixen com a vectors i transmeten virus d'un ésser viu a un altre, com ho fan els pugons amb les plantes i els insectes hematòfags amb els animals. Els virus de la grip es contagien mitjançant la tos i els esternuts. Els norovirus i els rotavirus, causes habituals de la gastroenteritis vírica, es transmeten per via fecal-oral, és a dir, quan hi ha contacte entre les mans i la boca o quan es consumeixen aliments o begudes que contenen el virus. En els éssers humans, la dosi infecciosa dels norovirus és de menys de 100 partícules víriques.[10] El virus de la immunodeficiència humana (VIH) és un dels virus que es transmeten per contacte sexual i per exposició a sang contaminada. El conjunt de cèl·lules que pot infectar un virus és el seu espectre d'hostes. En els animals, les infeccions víriques generen una resposta immunitària que sol eliminar el virus. Les vacunes també poden induir una resposta immunitària i conferir una immunitat adquirida artificial a la infecció vírica en qüestió. Hi ha virus, com els que provoquen la sida, la infecció per virus del papil·loma humà i l'hepatitis vírica, que són capaços d'eludir aquestes respostes immunitàries i causar infeccions cròniques. S'han desenvolupat nombrosos antivírics. EtimologiaLa paraula virus prové del mot llatí virus, que es refereix al verí i altres substàncies nocives, i el seu ús en català es remunta al segle xv. Es fa servir igualment amb el sentit figurat de ‘cosa molt nociva’ o ‘verí’.[11] La paraula virulent, del mot llatí virulentus (‘verinós’), també data del segle xv.[12] El terme virió es refereix a una partícula vírica extracel·lular que té la capacitat d'infectar altres cèl·lules del mateix tipus que aquella que l'ha produït.[13] OrígensEls virus es poden trobar a tot arreu on hi ha formes de vida i probablement aparegueren poc després de les primeres cèl·lules procariotes.[14] Com que no deixen fòssils, l'ombra del dubte plana sobre els seus orígens i cal recórrer a tècniques de biologia molecular per mirar de deduir com evolucionaren.[15] A més a més, el material genètic dels virus es pot integrar en la línia germinal dels seus hostes, que aleshores el transmeten verticalment als seus descendents generació rere generació. Aquest fenomen ofereix informació extremament útil als paleoviròlegs que intenten traçar l'evolució de virus que ja existien milions d'anys enrere. Hi ha tres grans teories sobre l'origen dels virus:[16]
L'anàlisi informàtica de seqüències d'ADN dels virus i dels hostes està produint una millor comprensió de les relacions evolutives entre diferents virus i podria ajudar a identificar els avantpassats dels virus moderns. Fins al present, aquestes anàlisis no han ajudat a decidir quina (o quines) de les teories és correcta. Tanmateix, sembla improbable que tots els virus actualment coneguts comparteixin un avantpassat comú i probablement els virus han aparegut múltiples vegades en el passat per mitjà d'un o més mecanismes.[30] Les opinions difereixen sobre si els virus són una forma de vida o estructures orgàniques que interaccionen amb els éssers vius. Se'ls ha descrit com a «organismes al límit de la vida»,[31] car s'assemblen als organismes en el fet que tenen gens i evolucionen per selecció natural,[32] i es reprodueixen creant múltiples còpies de si mateixos per autoassemblatge. Tanmateix, tot i que tenen gens, manquen d'estructura cel·lular, aspecte que sovint és considerat la unitat bàsica de la vida. A més, els virus no tenen un metabolisme propi, i necessiten una cèl·lula hoste per crear nous productes. Per tant, no es poden reproduir a l'exterior d'una cèl·lula hoste (tot i que bacteris com ara Rickettsia i Chlamydia són considerats organismes vius tot i tenir la mateixa limitació). Les formes de vida acceptades utilitzen la divisió cel·lular per reproduir-se, mentre que els virus s'assemblen espontàniament dins les cèl·lules, cosa que és anàloga al creixement autònom dels cristalls. L'autoassemblatge dels virus dins de les cèl·lules té implicacions per l'estudi de l'origen de la vida,[33] car reforça la hipòtesi que la vida podria haver començat en forma de molècules orgàniques autoassemblants.[34] Història El 1884, el microbiòleg francès Charles Chamberland inventà un filtre (conegut actualment com a filtre Chamberland o filtre Chamberland-Pasteur) que té porus de mida inferior a la d'un bacteri. Així doncs, podia fer passar pel filtre una solució amb bacteris i eliminar-los completament de la solució.[35] El biòleg rus Dimitri Ivanovski utilitzà aquest filtre per a estudiar el que actualment es coneix com a virus del mosaic del tabac. Els seus experiments demostraren que els extractes de fulles moltes de plantes de tabac infectades encara eren infecciosos després de filtrar-los. Ivanovski suggerí que la infecció podria ser causada per una toxina produïda pels bacteris, però no perseguí la idea.[36] Aleshores, es creia que tots els agents infecciosos podien ser retinguts per filtres i cultivats en un medi amb nutrients (això formava part de la teoria germinal de les malalties).[37] El 1899, el microbiòleg neerlandès Martinus Beijerinck repetí els experiments i quedà convençut que es tractava d'una nova forma d'agent infecciós.[38] Observà que l'agent només es multiplicava dins de cèl·lules en divisió, però com que els seus experiments no mostraven que estigués compost de partícules, l'anomenà contagium vivum fluidum («germen vivent soluble») i reintroduí el terme «virus».[36] Beijerinck mantenia que els virus eren de naturalesa líquida, una teoria més tard descartada per Wendell Stanley, que demostrà que eren particulats.[36] El mateix any, el 1899, Friedrich Loeffler i Frosch passaren l'agent de la febre aftosa (l'aftovirus) per un filtre similar i descartaren la possibilitat d'una toxina a causa de l'alta dilució; arribaren a la conclusió que l'agent es podia replicar.[36] A principis del segle xx, el bacteriòleg anglès Frederick Twort descobrí els virus que infecten bacteris, que actualment es denominen bacteriòfags,[39] i el microbiòleg francocanadenc Félix d'Herelle descrigué virus que, quan se'ls afegia a bacteris cultivats en agarosa, produïen zones de bacteris morts. Diluí amb precisió una suspensió d'aquests virus i descobrí que les dilucions més altes, en lloc de matar tots els bacteris, formaven zones individuals d'organismes morts. Comptant aquestes zones, i multiplicant-les pel factor de dilució D'Herelle pogué calcular el nombre de virus de la suspensió.[40] A finals del segle xix, els virus eren definits en termes de la seva infectivitat, filtrabilitat, i la seva necessitat d'hostes vivents. Els virus només havien estat cultivats en plantes i animals. El 1906, Harrison inventà un mètode per cultivar teixits en limfa, i, el 1913, E. Steinhardt, C. Israeli i R. A. Lambert utilitzaren aquest mètode per a cultivar virus de Vaccinia en fragments de teixit corneal de conill porquí.[41] El 1928, H. B. Maitland i M. C. Maitland cultivaren virus Vaccinia en suspensions de ronyons picats de gallina. El seu mètode no fou adoptat àmpliament fins al 1950, quan es començà a cultivar poliovirus a gran escala per la producció de vacunes.[42] Un altre avenç es produí el 1931, quan el patòleg estatunidenc Ernest William Goodpasture cultivà el virus de la grip i diversos altres virus en ous fertilitzats de gallina.[43] El 1949, John F. Enders, Thomas Weller i Frederick Robbins cultivaren virus de la poliomielitis en cèl·lules cultivades d'embrions humans, sent el primer cop que es cultivava un virus sense utilitzar teixits animals sòlids o ous. Aquest treball permeté a Jonas Salk crear una vacuna efectiva contra la poliomielitis.[44] Amb la invenció de la microscòpia electrònica, el 1931, per part dels enginyers alemanys Ernst Ruska i Max Knoll, s'obtingueren les primeres imatges de virus.[45] El 1935, el bioquímic i viròleg estatunidenc Wendell Stanley examinà el virus del mosaic del tabac i descobrí que estava compost principalment de proteïnes.[46] Poc temps després, el virus fou separat en les seves parts de proteïnes i d'ARN.[47] El virus del mosaic del tabac fou un dels primers a ser cristal·litzats, i per tant, dels primers l'estructura de la qual pogué ser observada en detall. Les primeres imatges per difracció de rajos X del virus cristal·litzat foren obtingudes per Bernal i Fankuchen el 1941. Basant-se en les seves imatges, Rosalind Franklin descobrí l'estructura completa del virus el 1955.[48] El mateix any, Heinz Fraenkel-Conrat i Robley Williams demostraren que l'ARN purificat del virus del mosaic del tabac i les seves proteïnes d'embolcall poden assemblar-se per si sols, formant virus funcionals, suggerint que aquest mecanisme senzill era probablement com s'assemblaven els virus dins les cèl·lules hostes.[49] La segona meitat del segle xx fou l'edat daurada del descobriment de virus, i la majoria de les 2.000 espècies reconegudes de virus animals, vegetals i bacterians foren descobertes durant aquests anys.[50] El 1957, es descobriren l'arterivirus equí i la causa de la diarrea vírica bovina (un pestivirus). El 1963, el virus de l'hepatitis B fou descobert per Baruch Blumberg,[51] i el 1965, Howard Temin descrigué el primer retrovirus. La transcriptasa inversa, l'enzim clau que utilitzen els retrovirus per a traduir el seu ARN en ADN, fou descrita originalment el 1970, de manera independent per Howard Temin i David Baltimore.[52] El 1983, l'equip de Luc Montagnier de l'Institut Pasteur de França aïllà per primer cop el retrovirus actualment anomenat VIH.[53] Al segle xxi es descobrí un antivíric que consisteix en una macromolècula multifuncional amb efectes contra la resistència de diversos virus.[54] Estructura En la seva fase extracel·lular els virus presenten una àmplia diversitat de formes i mides, anomenades «morfologies». En aquesta fase se sol referir-se a aquests com a virions o partícules víriques. Els virus són unes cent vegades més petits que els bacteris. La majoria de virus estudiats tenen un diàmetre d'entre 10 i 300 nanòmetres. Alguns filovirus tenen una mida total de fins a 1.400 nm; tanmateix, només mesuren uns 80 nm de diàmetre.[55] La majoria de virus no poden ser observats amb un microscopi òptic, de manera que s'utilitzen microscopis electrònics de rastreig i de transmissió per visualitzar partícules víriques.[56] Per augmentar el contrast entre els virus i el rerefons s'utilitzen tincions denses en electrons. Són solucions de sals de metalls pesants com ara tungstè, que dispersen els electrons de les regions cobertes per la tinció. Quan les partícules víriques estan cobertes per la tinció (tinció positiva), s'obscureixen els detalls fins. La tinció negativa evita aquest problema, tenyint únicament el rerefons.[57] Una partícula vírica completa, coneguda com a virió, consisteix en àcid nucleic envoltat per una capa de protecció proteica anomenada càpsida. Les càpsides estan compostes de subunitats proteiques idèntiques anomenades capsòmers.[58] Alguns virus tenen un «embolcall» lipídic derivat de la membrana cel·lular de l'hoste. La càpsida està formada per proteïnes codificades pel genoma víric, i la seva forma és la base de la distinció morfològica.[59][60] Les subunitats proteiques codificades pels virus s'autoassemblen per formar una càpsida, generalment necessitant la presència del genoma víric. Tanmateix, els virus complexos codifiquen proteïnes que contribueixen en la construcció de la seva càpsida. Les proteïnes associades amb els àcids nucleics són conegudes com a nucleoproteïnes, i l'associació de proteïnes de la càpsida vírica amb àcids nucleics vírics rep el nom de nucleocàpsida. En general, hi ha quatre tipus principals de morfologia vírica: Helicoidal Les càpsides helicoïdals es componen d'un únic tipus de capsòmer apilat al voltant d'un eix central per formar una estructura helicoïdal que pot tenir una cavitat central, o tub buit. Aquesta formació produeix virions en forma de barra o de fil; poden ser curts i molt rígids, o llargs i molt flexibles. El material genètic, normalment ARN monocatenari, però a vegades ADN monocatenari, queda unit a l'hèlix proteica per interaccions entre l'àcid nucleic amb càrrega negativa i la càrrega positiva de les proteïnes. En general, la llargada d'una càpsida helicoïdal està en relació amb la llargada de l'àcid nucleic que conté, i el diàmetre depèn de la mida i la distribució dels capsòmers. El ben estudiat virus del mosaic del tabac és un exemple de virus helicoïdal.[61] Icosaèdrica La majoria de virus que infecten els animals són icosaèdrics o quasiesfèrics amb simetria icosaèdrica. Un icosàedre regular és la millor manera de formar una carcassa tancada a partir de subunitats idèntiques. El nombre mínim requerit de capsòmers idèntics és dotze, cadascun compost de cinc subunitats idèntiques. Molts virus, com els rotavirus, tenen més de dotze capsòmers i semblen esfèrics, tot mantenint aquesta simetria. Els capsòmers dels àpexs estan envoltats per cinc altres capsòmers i reben el nom de pentons. Els capsòmers de les cares triangulars estan envoltats per sis altres capsòmers i reben el nom d'hexons.[62] Embolcallada Algunes espècies de virus s'embolcallen en una forma modificada d'una de les membranes cel·lulars, o bé la membrana externa que envolta una cèl·lula hoste infectada, o bé membranes internes com ara la membrana nuclear o el reticle endoplasmàtic, aconseguint, així, una bicapa lipídica exterior coneguda com a embolcall víric. Aquesta membrana és emplenada de proteïnes codificades pel genoma víric i el de l'hoste; la membrana lipídica en si i tots els carbohidrats presents són codificats completament per l'hoste. El virus de la grip i el del VIH utilitzen aquesta estratègia. La majoria de virus embolcallats depenen de l'embolcall per infectar.[63] Complexa Els virus tenen una càpsida que no és ni purament helicoïdal ni purament icosaèdrica, i que pot posseir estructures addicionals com ara cues proteiques o una paret exterior complexa. Alguns bacteriòfags tenen una estructura complexa que consisteix en un «cap» icosaèdric unit a una «cua» helicoïdal, que pot tenir una placa basal hexagonal amb fibres caudals proteiques que en sobresurtin. Els poxvírids són virus grans i complexos amb una morfologia inusual. El genoma víric està associat amb proteïnes dins d'una estructura discal central coneguda com a nucleoide. El nucleoide està envoltat per una membrana i dos cossos laterals de funció desconeguda. El virus té un embolcall exterior amb una espessa capa de proteïna a la superfície. La partícula en general és lleugerament pleomorfa, amb una forma que pot anar de la d'un ou a la d'un maó.[64] Mimivirus és el virus més gran conegut, amb un diàmetre de càpsida de 400 nm. De la seva superfície es projecten filaments proteics de 100 nm. La càpsida apareix hexagonal al microscopi electrònic, de manera que és probablement icosaèdrica.[65] Genoma
Es pot veure una enorme varietat d'estructures genòmiques entre les espècies de virus; com a grup, contenen una diversitat genòmica superior a la dels regnes sencers de les plantes, els animals o els bacteris. Un virus té gens composts o bé d'ADN o bé d'ARN, i reben respectivament els noms de virus d'ADN i virus d'ARN. La gran majoria de virus utilitzen l'ARN. Els virus de les plantes tendeixen a tenir ARN monocatenari i els bacteriòfags tendeixen a tenir ADN bicatenari.[66] Els genomes vírics són o bé circulars, com els poliomavírids, o bé lineals, com els adenovírids. El tipus d'àcid nucleic és irrellevant per la forma del genoma. En els virus d'ARN, el genoma sovint està dividit en parts separats dins del virió, i se'l qualifica de «segmentat». Cada segment sol codificar una proteïna i els segments solen estar reunits en una càpsida. No cal que cada segment es trobi al mateix virió perquè el virus en general sigui infecciós, com ho demostra el virus del mosaic dels Bromus.[55] Independentment del tipus d'àcid nucleic, un genoma víric pot ser o bé monocatenari o bé bicatenari. Els genomes monocatenaris consisteixen en un àcid nucleic no emparellat, semblant a la meitat d'una escala de mà tallada per la meitat. Els virus bicatenaris tenen dos àcids nucleics emparellats complementaris, semblants a una escala de mà sencera. Alguns virus, com ara els hepadnavírids, contenen un genoma que és parcialment bicatenari i parcialment monocatenari.[66] En els virus d'ARN i els virus d'ADN monocatenari, les cadenes poden ser o bé positives (cadenes plus) o negatives (cadenes minus), depenent de si són complementàries a l'ARN missatger (ARNm) víric. L'ARN víric positiu és idèntic a l'ARNm víric i per tant pot ser traduït immediatament per la cèl·lula hoste. L'ARN víric negatiu és complementari a l'ARNm i per tant ha de ser convertit en ARN positiu per una ARN polimerasa abans de ser traduït. La nomenclatura de l'ADN és similar a la de l'ARN, en què la «cadena codificadora» de l'ARNm víric li és complementària (-), i la «cadena no codificadora» n'és una còpia (+).[66] La mida del genoma varia molt d'una espècie a l'altra, els virus amb un genoma més gran, descoberts l'any 2013, són els Pandoravirus amb 1,9 a 2,5 megabases. Els genomes vírics més petits només codifiquen quatre proteïnes i pesen uns 10⁶ daltons; els més grans pesen uns 108 daltons i codifiquen més d'un centenar de proteïnes.[66] Els virus d'ARN solen tenir genomes més petits que els virus d'ADN a causa d'una taxa d'error més alta a l'hora de replicar-se, i tenen un límit superior de mida. Per sobre aquest límit, els errors en la replicació del genoma fan que el virus sigui inofensiu o incompetitiu. Per a compensar això, els virus d'ARN sovint tenen genomes segmentats en què el genoma és separat en molècules més petites, reduint així les possibilitats d'error. En canvi, els virus d'ADN tenen genomes més grans gràcies a l'elevada fidelitat dels seus enzims de replicació.[67] Canvi genètic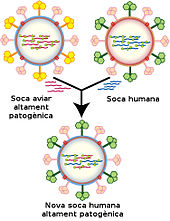 Els virus pateixen canvi genètic per diversos mecanismes. Aquests inclouen un procés anomenat deriva genètica en què bases individuals de l'ADN o l'ARN muten en altres bases. La majoria d'aquestes mutacions puntuals són imperceptibles en què no canvien la proteïna que codifica el gen, però d'altres poden conferir avantatges evolutius com ara resistència als medicaments antivírics.[68] El canvi antigènic es produeix quan hi ha un canvi significatiu en el genoma del virus. Això passa com a resultat de recombinació genètica o reassortment. Quan això es produeix en els virus de la grip, en poden resultar pandèmies.[69] Els virus d'ARN solen existir com a quasiespècies o eixams de virus de la mateixa espècie però amb seqüències de nucleòsids del genoma lleugerament diferents. Aquestes quasi espècies són un objectiu destacat per la selecció natural.[70] Els genomes segmentats ofereixen avantatges evolutius; diferents soques d'un virus amb el genoma segmentat poden intercanviar i combinar gens, produint virus progènie (o descendència) amb característiques úniques. Això rep el nom de reassortment o «sexe víric».[71] La recombinació genètica és el procés pel qual una cadena d'ADN és trencada i després unida a l'extrem d'una molècula d'ADN diferent. Això es pot produir quan diferents virus infecten les mateixes cèl·lules alhora, i estudis de l'evolució dels virus han demostrat que la recombinació té un paper molt important en les espècies estudiades.[72] La recombinació és comuna als virus d'ARN i els virus d'ADN.[73][74] Replicació víricaLes poblacions víriques no creixen per divisió cel·lular, car són acel·lulars; en canvi, utilitzen la maquinària i el metabolisme d'una cèl·lula hoste per a produir nombroses còpies de si mateixos, i es «munten» a la cèl·lula. Cicle de replicació El cicle vital dels virus difereix significativament entre espècies, però hi ha sis etapes bàsiques en el cicle vital víric:[75]
Virus d'ADNLa replicació del genoma de la majoria de virus d'ADN es produeix al nucli de la cèl·lula. Si la cèl·lula té el receptor adient a la superfície, aquests virus hi entren per fusió amb la membrana cel·lular o per endocitosi. La majoria de virus d'ADN són completament dependents de la maquinària de síntesi d'ADN i ARN de la cèl·lula hoste, i la seva maquinària de processament d'ARN. El genoma víric ha de travessar la membrana nuclear de la cèl·lula per a accedir a aquesta maquinària.[80][81] Virus d'ARNEls virus d'ARN són únics perquè la seva informació genètica està codificada en ARN. La replicació se sol produir al citoplasma. Els virus d'ARN es poden classificar en uns quatre grups segons el seu mode de replicació. La polaritat de l'ARN (si pot ser utilitzat directament o no per a produir proteïnes) determina en gran manera el mecanisme de replicació, i si el material genètic és monocatenari o bicatenari. Els virus d'ARN utilitzen les seves pròpies ARN replicases per crear còpies del seu genoma.[82] Virus de transcripció inversaEls virus de transcripció inversa es repliquen per mitjà de la transcripció inversa, que és la formació d'ADN a partir d'una plantilla d'ARN. Els virus de transcripció inversa que contenen un genoma d'ARN utilitzen un intermedi d'ADN per a replicar-se, mentre que els que contenen un genoma d'ADN utilitzen un intermedi d'ARN durant la replicació del genoma. Ambdós tipus utilitzen l'enzim transcriptasa inversa per a catalitzar la conversió d'àcids nucleics. Els retrovirus sovint integren l'ADN produït per la transcripció inversa al genoma de l'hoste. Són susceptibles a medicaments antivírics que inhibeixen la transcriptasa inversa, com la zidovudina o la lamivudina. Un exemple del primer tipus és el VIH, que és un retrovirus. Els exemples del segon tipus inclouen els hepadnavírids, que inclouen el virus de l'hepatitis B.[83] Efectes sobre la cèl·lula hosteLa varietat d'efectes estructurals i bioquímics dels virus sobre les cèl·lules hoste és gran.[84] Reben el nom d'«efectes citopàtics».[85] La majoria d'infeccions víriques acaben provocant la mort de la cèl·lula hoste. Les causes de la mort inclouen la lisi de la cèl·lula, alteracions de la membrana superficial de la cèl·lula i apoptosi.[86] Sovint, la mort de la cèl·lula és causada per l'aturada de les seves activitats normals a causa de la supressió per proteïnes específiques del virus, que no són totes components de la partícula vírica.[87] Alguns virus no causen canvis aparents a la cèl·lula infectada. Les cèl·lules en què els virus és latent i inactiu presenten pocs signes d'infecció i sovint funcionen normalment.[88] Això causa infeccions persistents i el virus sovint roman dorment durant molts mesos o anys. Aquest sol ser el cas dels herpes simples.[89][90] Alguns virus, com el virus d'Epstein-Barr, sovint fan proliferar les cèl·lules sense causar malignitat,[91] però d'altres, com els papil·lomavirus, són una causa demostrada de càncer.[92] ClassificacióLes classificacions intenten descriure la diversitat de virus donant-los nom i agrupant-los segons les seves semblances. El 1962, André Lwoff, Robert Horne i Paul Tournier foren els primers a desenvolupar una forma de classificació dels virus, basada en el sistema jeràrquic linneà.[93] Aquest sistema basa la classificació en fílums, classes, ordres, famílies, gèneres i espècies. Els virus foren agrupats segons les seves propietats compartides (no les dels seus hostes) i el tipus d'àcid nucleic de què es compon el seu genoma.[94] Més tard es fundà el Comitè Internacional de Taxonomia dels Virus. Classificació de l'ICTVEl Comitè Internacional de Taxonomia dels Virus (ICTV) desenvolupà el sistema de classificació actual i escrigué pautes que donaven més importància a certes propietats dels virus per mantenir la uniformitat familiar. Un sistema universal per classificar els virus i una taxonomia unificada han estat establerts des del 1966. El 7è Informe de l'ICTV formalitzà per primera vegada el concepte d'espècie vírica com el tàxon més baix d'una jerarquia ramificada de tàxons de virus.[95] Tanmateix, actualment només s'ha estudiat una petita part de tota la diversitat dels virus, i anàlisis de mostres obtingudes d'humans revelen que aproximadament un 20% de seqüències víriques recuperades no han estat observades anteriorment. Mostres de l'ambient, com ara sediments marins i oceànics, revelen que la gran majoria de seqüències són completament noves.[96] L'estructura taxonòmica general és la següent:
La taxonomia actual de l'ICTV (2008) reconeix cinc ordres: els caudovirals, els herpes virals, els mononegavirals, els nidovirals i els picornavirals. El comitè no distingeix formalment entre subespècies, soques i aïllaments. En total, hi ha cinc ordres, 82 famílies, 11 subfamílies, 307 gèneres, 2.083 espècies i uns 3.000 tipus que encara no han estat classificats.[97][98] Classificació de Baltimore El biòleg guanyador del Premi Nobel David Baltimore dissenyà el sistema de classificació de Baltimore.[52][99] El sistema de classificació de l'ICTV és utilitzat en combinació amb el sistema de classificació de Baltimore en la classificació moderna dels virus.[100][101][102] La classificació de Baltimore dels virus es basa en el mecanisme de producció d'ARNm. Els virus han de generar ARNm del seu genoma per produir proteïnes i replicar-se, però cada família de virus utilitza mecanismes diferents. El genoma dels virus pot ser monocatenari (ss) o bicatenari (ds), d'ARN o ADN, i poden utilitzar o no la transcriptasa inversa. A més, els virus d'ARN monocatenari poden ser o bé positius (+) o bé negatius (-). Aquesta classificació reparteix els virus en set grups:
Com a exemple de la classificació vírica, el virus de la varicel·la, varicel·la zòster (VZV), pertany a l'ordre dels herpesvirals, la família dels herpesvírids, la subfamília dels alfaherpesvirins i el gènere Varicellovirus. El VZV es troba al grup I de la classificació de Baltimore perquè és un virus dsDNA que no utilitza la transcriptasa inversa. Malalties víriques dels humansExemples de malalties humanes comunes provocades per virus inclouen el refredat, la grip, la varicel·la i l'herpes simple. Moltes malalties greus com la febre hemorràgica de l'Ebola, la sida, la grip aviària i la SARS són causades per virus. La capacitat relativa dels virus de provocar malalties es descriu en termes de virulència. Altres malalties estan sent investigades per descobrir si el seu agent causant també és un virus, com ara la possible connexió entre l'herpesvirus humà 6 (HHV6) i malalties neurològiques com ara l'esclerosi múltiple i la síndrome de fatiga crònica. Hi ha polèmica sobre si el bornavirus, antigament considerat la causa de malalties neurològiques en els cavalls, podria ser la causa de malalties psiquiàtriques en els humans.[103]  Els virus tenen diferents mecanismes per mitjà dels quals causen malalties a un organisme, que depenen en gran manera en l'espècie de virus. Els mecanismes a nivell cel·lular inclouen principalment la lisi de la cèl·lula, és a dir, el trencament i posterior mort de la cèl·lula. En els organismes pluricel·lulars, si moren massa cèl·lules, l'organisme en general començarà a patir-ne els efectes. Tot i que els virus causen una disrupció de l'homeòstasi saludable, provocant una malaltia, també poden existir de manera relativament inofensiva dins un organisme. Un exemple seria la capacitat del virus de l'herpes simple de romandre en un estat dorment dins del cos humà. Això rep el nom de «latència»[104] i és una característica de tots els herpesvirus, incloent-hi el virus d'Epstein-Barr (que causa mononucleosi infecciosa) i el virus de la varicel·la zòster (que causa la varicel·la). Les infeccions latents de varicel·la tornen més endavant en la vida en forma de la malaltia anomenada herpes zòster). Alguns virus poden causar infeccions permanents o cròniques, en què els virus continuen replicant-se al cos malgrat els mecanismes de defensa de l'hoste.[105] Això és habitual en les infeccions de virus de l'hepatitis B i de l'hepatitis C. Els malalts crònics són coneguts com a portadors, car serveixen de reservori dels virus infecciosos.[106] En poblacions amb una proporció elevada de portadors, es diu que la malaltia és endèmica.[107] EpidemiologiaL'epidemiologia vírica és la branca de la ciència mèdica que estudia la transmissió i el control d'infeccions víriques en els humans. La transmissió de virus pot ser vertical (de mare a fill) o horitzontal (d'una persona a l'altra). Exemples de transmissió vertical inclouen el virus de l'hepatitis B o el VIH, en què el bebè ja neix infectat amb el virus.[108] Un altre exemple més rar és el virus de la varicel·la zòster. Normalment causa infeccions relativament lleus en els humans, però pot resultar fatal pels fetus i els bebès nounats.[109] La transmissió horitzontal és el mecanisme de contagi de virus més estès. La transmissió pot ser per intercanvi de sang per activitat sexual (ex., VIH, hepatitis B i hepatitis C), per la boca per l'intercanvi de saliva (ex., virus d'Epstein-Barr), per aliments o aigua contaminats (ex., norovirus), per la respiració de virus en forma d'aerosol (ex., virus de la grip) o per insectes vectors com ara els mosquits (ex., dengue). La taxa i la velocitat de la transmissió d'infeccions víriques depenen de factors com ara la densitat de població, el nombre d'individus susceptibles (els que no són immunes),[110] la qualitat del sistema sanitari i el temps.[111] L'epidemiologia es fa servir per trencar la cadena d'infeccions en poblacions durant brots de malalties víriques.[112] S'utilitzen mesures de control basant-se en el coneixement del mode de transmissió del virus. Una vegada s'ha identificat el virus, a vegades es pot trencar la cadena d'infeccions per mitjà de vacunes. Quan no es pot comptar amb vacunes, poden resultar eficients el sanejament i la desinfecció. Sovint s'aïllen les persones infectades de la resta de la comunitat, i els que han estat exposats al virus són posats en quarantena.[113] Per controlar el brot de febre aftosa en bovins britànics el 2001, se sacrificaren milers de caps de bestiar.[114] La majoria d'infeccions víriques dels humans i altre animals tenen un període d'incubació durant el qual la infecció no causa cap signe o símptoma.[115] Els períodes d'incubació de les malalties víriques van des d'uns quants dies fins a setmanes, però són coneguts en el cas de moltes infeccions.[116] Després del període d'incubació hi ha un «període de comunicabilitat»; un temps durant el qual l'individu o animal infectat és contagiós i pot infectar una altra persona o animal.[117] Aquest període també és conegut en moltes infeccions, i el coneixement de la llargada d'ambdós períodes és important en el control de brots.[118] Quan un brot causa una proporció particularment elevada d'infeccions en una població, comunitat o regió, se l'anomena epidèmia. Si un brot s'estén arreu del món, se l'anomena pandèmia.[119] Epidèmies i pandèmies Les poblacions ameríndies foren devastades per malalties contagioses, especialment la verola, portades a les Amèriques per colons europeus. És incert el nombre de nadius americans morts per malalties estrangeres després de l'arribada de Colom a Amèrica, però s'ha estimat que fou el 70% de la població indígena. Els estralls causats per aquesta malaltia contribuïren significativament als intents dels europeus de foragitar o conquerir la població nadiua.[120] Una pandèmia és una epidèmia global. La pandèmia de grip de 1918, sovint anomenada grip espanyola, fou una pandèmia de grip de categoria 5 provocada per un virus de la grip A particularment greu i mortal. Les víctimes sovint eren adults joves sans, en contrast amb la majoria de brots de grip, que afecten predominantment pacients joves, grans o febles.[121] La pandèmia de grip espanyola durà de 1918 al 1919. Les estimacions més antigues diuen que matà 40-50 milions de persones,[122] mentre que les més recents suggereixen que podria haver mort fins a 100 milions de persones, o un 5% de la població mundial el 1918.[123] La majoria d'investigadors creuen que el VIH s'originà a l'Àfrica subsahariana durant el segle xx;[124] i actualment és una pandèmia, amb un nombre estimat de 38,6 milions de malalts arreu del món.[125] El Programa Conjunt de les Nacions Unides sobre el VIH/SIDA (UNAIDS) i l'Organització Mundial de la Salut (OMS) estimen que la sida ha mort més de 25 milions de persones des que fou reconeguda per primer cop el 5 de juny de 1981, sent una de les epidèmies més destructives de la història escrita.[126] L'Agència de Salut Pública de Catalunya ha registrat 613 nous diagnòstics de SIDA durant el 2018, un 4,9% menys en relació al 2017 i un 26,7% menys respecte al 2013.[127]  Alguns patògens vírics molt letals són membres de la família dels filovírids. Els filovirus són virus semblants a filaments que causen la febre hemorràgica vírica, i inclouen l'ebola i els virus de Marburg. El virus de Marburg atragué l'atenció de la premsa a l'abril de 2005 per un brot a Angola. El brot, que començà el 2004 i s'estengué el 2005, fou la pitjor epidèmia del món de qualsevol tipus de febre hemorràgica vírica.[128] CàncerEls virus són una causa establerta de malignitats (càncer) en els humans i altres espècies. Els virus més importants associats amb càncers humans són el virus del papil·loma humà, el virus de l'hepatitis B, el Virus d'Epstein-Barr, i el virus T-limfotròpic humà. Els virus de l'hepatitis poden causar una infecció crònica que provoca càncer de fetge.[129][130] La infecció amb virus T-limfotròpic humà pot causar paraparèsia espàstica tropical i leucèmia de limfòcits T de l'adult.[131] Els papil·lomavirus humans són una causa establerta de càncer de cèrvix, pell, anus i penis.[132] Dins dels herpesvírids, l'herpesvirus humà 8 causa sarcoma de Kaposi i limfoma de les cavitats corporals, i el virus d'Epstein-Barr causa limfoma de Burkitt, limfoma de Hodgkin, trastorn limfoproliferatiu dels limfòcits B i carcinoma nasofaringi.[133] Mecanismes de defensa dels hostesLa primera línia de defensa contra els virus és el sistema immunitari innat. Aquest sistema inclou les cèl·lules i altres mecanismes que defensen l'hoste de les infeccions d'una manera no específica. Això significa que les cèl·lules del sistema innat reconeixen i responen als patògens d'una manera genèrica, però a diferència del sistema immunitari adaptatiu, no confereix una immunitat permanent o protectora a l'hoste.[134] La interferència de l'ARN és una defensa innata important contra els virus.[135] Molts virus tenen una estratègia de replicació que implica ARN bicatenari (dsRNA). Quan un virus d'aquests infecta una cèl·lula allibera la seva molècula o molècules d'ARN, que s'uneixen immediatament a un complex proteic anomenat dicer que talla l'ARN en trossos més petits. S'activa una ruta bioquímica anomenada complex RISC que degrada l'ARNm víric i la cèl·lula sobreviu a la infecció. Els rotavirus eviten aquest mecanisme, no desembolcallant-se completament dins la cèl·lula i alliberant l'ARNm acabat de produir a través de porus de la càpsida interna de la partícula. El dsRNA genòmic roman protegit al nucli del virió.[136][137] Quan el sistema immunitari adaptatiu d'un vertebrat es troba amb un virus, produeix anticossos específics que s'uneixen al virus i fan que deixi de ser infecciós. Això rep el nom d'immunitat humoral. Dos tipus d'anticossos són importants. El primer, anomenat IgM, és altament eficient a l'hora de neutralitzar virus però només és produït per les cèl·lules del sistema immunitari durant unes poques setmanes. El segon, anomenat IgG, és produït indefinidament. La presència d'IgM a la sang de l'hoste és utilitzada per a detectar infeccions agudes, mentre que les IgG indiquen una infecció en algun moment del passat.[138] Es mesuren els anticossos IgG quan es duen a terme proves d'immunitat.[139]  Una segona defensa dels vertebrats contra els virus és l'anomenada immunitat cel·lular i implica cèl·lules immunitàries conegudes com a limfòcits T. Les cèl·lules del cos presenten contínuament petits fragments de les seves proteïnes a la superfície, i si un limfòcit T hi reconeix un fragment víric sospitós, la cèl·lula hoste és destruïda per limfòcits T citotòxics i els limfòcits T virus-específics proliferen. Cèl·lules com ara els macròfags són especialistes d'aquesta presentació d'antigen.[140] La producció d'interferó és un mecanisme important de defensa de l'hoste. Es tracta d'una hormona produïda pel cos quan hi ha virus presents. El seu rol en la immunitat és complex, però finalment impedeix que es reprodueixin els virus matant la cèl·lula infectada i les seves veïnes properes.[141] No totes les infeccions víriques produeixen una resposta immunitària protectora d'aquesta manera. El VIH evita el sistema immunitari canviant constantment la seqüència d'aminoàcids de la superfície del virió. Aquests virus persistents eviten el control immunitari per segrest, bloqueig de la presentació d'antigen, resistència a les citocines, fugida de les cèl·lules NK, fugida de l'apoptosi, i canvi antigènic.[142] Altres virus, anomenats virus neurotròpics, són disseminats per dispersió neural, on el sistema immunitari pot ser incapaç d'arribar-hi. Prevenció i tractamentCom que els virus utilitzen la maquinària d'una cèl·lula hoste per reproduir-se i resideixen a l'interior, són difícils d'eliminar sense matar la cèl·lula hoste. Els enfocaments mèdics més eficients per enfrontar-se a les malalties víriques conegudes fins ara són les vacunes, que ofereixen resistència a la infecció, i els antivírics. VacunesLa vacunació és una manera barata i eficient d'evitar infeccions víriques. Les vacunes foren utilitzades per prevenir infeccions víriques molt abans del descobriment dels virus mateixos. El seu ús ha resultat en un declivi dramàtic de la morbiditat (malaltia) i mortalitat (mort) associades amb infeccions víriques com ara la poliomielitis, el xarampió, la parotiditis i la rubèola.[143] Les infeccions de verola han estat erradicades.[144] Actualment, es disposa de vacunes per tractar més de tretze infeccions víriques dels humans,[145] i n'hi ha més que s'utilitzen per prevenir infeccions víriques dels animals.[146] Les vacunes poden estar compostes de virus vius atenuats o de morts, o de proteïnes víriques (antígens).[147] Les vacunes vives contenen formes afeblides del virus que causa la malaltia. Aquests virus són denominats «atenuats». Les vacunes vives poden resultar perilloses quan se les administra a persones amb una immunitat dèbil (els immunocompromesos), car el virus afeblit pot causar-los la malaltia original.[148] S'utilitzen tècniques de biotecnologia i enginyeria genètica per produir vacunes de subunitats. Aquestes vacunes només utilitzen les proteïnes de la càpsida del virus. La vacuna del virus de l'hepatitis B n'és un exemple.[149] Les vacunes de subunitats són segures pels pacients immunocompromesos car no causen la malaltia.[150] Tanmateix, la vacuna del virus de la febre groga, una soca viva atenuada anomenada 17D, és probablement la vacuna més segura i eficient mai creada.[151] AntivíricsAl llarg dels últims vint anys, el desenvolupament de medicaments antivírics ha augmentat ràpidament, impulsat per l'epidèmia de la SIDA. Els antivírics sovint són anàlegs de nucleòsids (parts d'ADN falses), que els virus incorporen al genoma durant la seva replicació. El cicle vital dels virus queda aturat perquè l'ADN acabat de sintetitzar és inactiu. Això és perquè els anàlegs manquen dels grups hidroxils, que, juntament amb els àtoms de fòsfor, s'uneixen per a formar la forta «columna» de la molècula d'ADN. Això rep el nom de terminació de cadena d'ADN.[152] Exemples d'anàlegs de nucleòsids són l'aciclovir (per les infeccions amb virus d'herpes simple) i la lamivudina (per les infeccions amb VIH i virus de l'hepatitis B). L'aciclovir és un dels antivírics més antics i més sovint receptats.[153] Altres medicaments antivírics ataquen diferents etapes del cicle víric. El VIH depèn d'un enzim proteolític anomenat VIH-1 proteasa per tal d'esdevenir completament infecciós. Hi ha una gran classe de medicaments anomenats inhibidors de la proteasa que desactiven aquest enzim. L'hepatitis C és causada per un virus d'ARN. En el 80% dels infectats, la malaltia és crònica, i sense tractament romandran infectats durant la resta de la seva vida. Tanmateix, actualment existeix un tractament eficient que utilitza l'anàleg de nucleòsid ribavirina en combinació amb interferó.[154] S'ha desenvolupat un tractament pels portadors crònics del virus de l'hepatitis B mitjançant una estratègia similar amb lamivudina.[155] Infecció d'altres organismesEls virus infecten totes menes de vida cel·lular i, tot i que existeixen arreu del món, cada espècie cel·lular té el ventall de virus específic, que sovint només infecten aquesta espècie.[156] Els virus són importants patògens del bestiar. Malalties com la febre aftosa i la llengua blava són causades per virus.[157] Els animals de companyia (com gats, gossos i cavalls), si no se'ls vacuna, són susceptibles a infeccions víriques greus. El parvovirus caní és causat per un petit virus d'ADN i les infeccions sovint són fatals en els cadells.[158] Com tots els invertebrats, l'abella de la mel és susceptible a moltes infeccions víriques.[159] Afortunadament, la majoria de virus coexisteixen de manera inofensiva amb el seu hoste i no causen signes o símptomes de malaltia.[37] Plantes Hi ha molts tipus de virus de les plantes, però sovint només causen una pèrdua de producció, i no és econòmicament viable intentar controlar-los. Els virus de les plantes sovint són transmesos d'una planta a una altra per organismes coneguts com a vectors. Normalment són insectes, però també s'ha demostrat que alguns fongs, nematodes i organismes unicel·lulars són vectors. Quan es considera econòmic el control d'infeccions per fitovirus (en els fruits perennes, per exemple), els esforços es concentren en matar els vectors i eliminar hostes alternatius com ara males herbes.[160] Els fitovirus són inofensius pels humans i la resta d'animals, car només es poden reproduir en cèl·lules vegetals vives.[161] Les plantes tenen mecanismes de defensa elaborats i eficients contra els virus. Un dels més eficients és la presència dels anomenats gens de resistència (R). Cada gen R confereix resistència a un virus determinat desencadenant zones localitzades de mort cel·lular al voltant de la cèl·lula infectada, que es poden veure a ull nu en forma de taques grans. Això atura l'expansió de la infecció.[162] La interferència de l'ARN també és una defensa efectiva en les plantes.[163] Quan estan infectades, les plantes sovint produeixen desinfectants naturals que maten els virus, com l'àcid salicílic, l'òxid nítric i molècules reactives d'oxigen.[164] Bacteris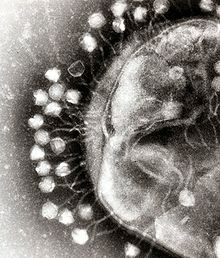 Els bacteriòfags són un grup extremament comú i divers de virus. Per exemple, els bacteriòfags són la forma més comuna d'entitat biològica als medis aquàtics; als oceans hi ha fins a deu vegades més d'aquests virus que de bacteris,[165] assolint nivells de 250 milions de bacteriòfags per mil·límetre d'aigua marina.[166] Aquests virus infecten bacteris específics unint-se a molècules receptores de superfície i entrant a la cèl·lula. En un breu període (en alguns casos en uns minuts), les polimerases bacterianes comencen a traduir ARNm víric en proteïna. Aquestes proteïnes esdevenen nous virions dins la cèl·lula, proteïnes col·laboradores que ajuden a acoblar nous virions, o proteïnes implicades en la lisi cel·lular. Els enzims vírics col·laboren en la destrucció de la membrana cel·lular i, en el cas del fag T4, una mica més de vint minuts després de la injecció ja es poden alliberar més de 300 fags.[167] El mecanisme principal pel qual els bacteris es defensen dels bacteriòfags és produint enzims que destrueixen l'ADN aliè. Aquests enzims, anomenats endonucleases de restricció, fragmenten l'ADN víric que els bacteriòfags introdueixen a les cèl·lules bacterianes.[168] Els bacteris també tenen un sistema que utilitza seqüències CRISPR per retenir fragments del genoma de virus que s'han trobat en el passat, cosa que els permet impedir la replicació del virus mitjançant una forma d'interferència de l'ARN.[169][170] Aquest sistema genètic proporciona als bacteris una immunitat adquirida a les infeccions. ArqueusAlguns virus es repliquen dins dels arqueus; es tracta de virus d'ADN que semblen no tenir relació amb cap altra forma de virus i que tenen una varietat de formes inusuals; alguns semblen ampolles, barres amb un ganxo o fins i tot llàgrimes.[171] Aquests virus han estat estudiats en major detall en els arqueus termòfils, especialment els ordres dels sulfolobals i termoproteals.[172] Les defenses contra aquests virus poden incloure la interferència de l'ARN de seqüències repetides d'ADN del genoma arqueual, que estan relacionades amb els gens dels virus.[173][174] UsosCiències de la vida i medicinaEls virus són importants per l'estudi de la biologia molecular i cel·lular, car són sistemes senzills que es poden utilitzar per manipular i investigar el funcionament de les cèl·lules.[175] L'estudi i l'ús dels virus han ofert informació valuosa sobre aspectes de la biologia cel·lular.[176] Per exemple, els virus han resultat útils en l'estudi de la genètica i han contribuït a comprendre els mecanismes bàsics de la genètica molecular, com ara la replicació de l'ADN, la transcripció, la maduració de l'ARN, la traducció, el transport de proteïnes i la immunologia. Els genetistes sovint utilitzen virus com a vectors per introduir gens en cèl·lules que estan estudiant. Això és útil per fer que la cèl·lula produeixi una substància aliena, o per estudiar l'efecte de la introducció d'un nou gen al genoma. De manera similar, la viroteràpia utilitza virus com a vectors per tractar diverses malalties, car poden dirigir-se específicament a cèl·lules i ADN. Té un ús prometedor en el tractament del càncer i en la teràpia gènica. Científics de l'est d'Europa han utilitzat la teràpia fàgica com a alternativa als antibiòtics des de fa un temps, i l'interès per aquest enfocament està creixent a causa de l'alt nivell de resistència als antibiòtics observat actualment en alguns bacteris patògens.[177] Ciència de materials i nanotecnologia Les tendències actuals en nanotecnologia prometen fer un ús molt més versàtil dels virus. Des del punt de vista d'un científic de materials, els virus poden ser considerats nanopartícules orgàniques. La seva superfície porta eines específiques dissenyades per creuar les barreres de la cèl·lula hoste. La mida i la forma dels virus, així com el nombre i la naturalesa dels grups funcionals de la seva superfície, estan definides amb precisió. Per tant, els virus són utilitzats habitualment en ciència de materials com a carcasses de modificacions de superfície unides de manera covalent. Una qualitat particular dels virus és que poden ser dissenyats per evolució dirigida. Les tècniques potents desenvolupades per les ciències de la vida estan esdevenint la base d'enfocaments d'enginyeria vers els nanomaterials, obrint una gran varietat d'usos molt més enllà de la biologia i la medicina.[178] A causa de la seva mida, forma i estructures químiques ben definides, els virus han estat utilitzats com a plantilles per organitzar materials a la nanoescala. Exemples recents inclouen el treball fet al Naval Research Laboratory de Washington DC, utilitzant partícules del virus del mosaic del fesolet (CPMV) per amplificar senyals en sensors basats en xips d'ADN. En aquest ús, les partícules víriques separen les tincions fluorescents utilitzades per senyalar per tal d'evitar la formació de dímers no fluorescents que actuen com a extintors.[179] Un altre exemple és l'ús del CPMV com a nanoplaca de proves per l'electrònica molecular.[180] ArmamentLa capacitat dels virus de causar epidèmies devastadores en les societats humanes ha aixecat la preocupació que es puguin convertir virus en armes biològiques. La preocupació augmentà després que s'aconseguís recrear l'infame virus de la grip espanyola en un laboratori.[181] El virus de la verola devastà nombroses societats al llarg de la història abans de ser erradicat. Actualment, només existeix en diversos laboratoris segurs a diversos llocs del món, però els temors que pugui ser utilitzat com a arma no estan totalment infundats; la vacuna de la verola no és segura – durant els anys anteriors a l'erradicació de la verola, més gent caigué greument malalta com a resultat de la vacunació que no pas de la verola en si[182] – i la vacunació per la verola ja no és practicada universalment.[183] Per aquest motiu, gran part de la població humana actual gairebé no té resistència a la verola. Si fos alliberat, es podria sofrir una pèrdua de vides colossal abans que el virus fos controlat. Referències
Bibliografia
|
||||||||||||||||||||||||||||||||||||||


