|
Heparina
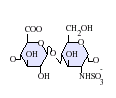
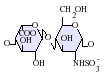
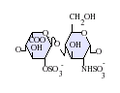
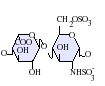
L'heparina és un glicosaminoglicà altament sulfatat, es fa servir molt com a anticoagulant injectable, i té la densitat de càrrega negativa més alta de qualsevol biomolècula coneguda.[1] També es pot utilitzar per formar una superfície anticoagulant a l'interior de diversos aparells experimentals i mèdics com tubs d'assaig i màquines de diàlisi renal. L'heparina farmacèutica s'obté de teixits mucosos de la carn d'animals sacrificats, com intestí de porc o pulmó de vaca.[2] Tot i que s'utilitza principalment en medicina per a l'anticoagulació, el veritable paper fisiològic en el cos humà no és clar, perquè l'anticoagulació de la sang s'aconsegueix principalment pel proteoglicà heparan sulfat obtingut de les cèl·lules endotelials.[3] L'heparina normalment és emmagatzemada dins dels grànuls de secreció dels mastòcits i alliberada només dins del sistema circulatori en llocs de lesió de teixits. S'ha proposat que, més que l'anticoagulació, la principal funció de l'heparina és ser un mecanisme de defensa, en llocs de lesió de teixits, contra els bacteris invasors i altres materials estranys pel cos.[4] A més a més, es conserva a través d'un gran nombre d'espècies diferents, incloent alguns invertebrats que no tenen un sistema de coagulació de la sang similar. Estructura de l'heparinaL'heparina nativa és un polímer amb un pes molecular d'entre 3 i 50 kDa, tot i que la mitjana de pes molecular de la majoria de preparacions d'heparina està entre 12 i 15 kDa. L'heparina és un membre de la família dels glicosaminoglicans dels carbohidrats (que inclou la molècula estretament relacionada heparan-sulfat) i consisteix en una unitat de disacàrid repetida amb variabilitat de sulfatació.[5] Les principals unitats de disacàrids que es troben en l'heparina es mostren més a baix. La unitat de disacàrid més comuna està composta per 2-O-àcid idurònic sulfatat i 6-O-sulfatat, N-glucosamina sulfatada, IdoA(2S)-GlcNS(6S). Per exemple, això constitueix un 85% de les heparines del pulmó de bou i aproximadament un 75% de les de la mucosa intestinal de porc.[6] A sota es mostren alguns dels disacàrids estranys que contenen 3-O-glucosamina sulfatada (GlcNS(3S,6S)) o un grup amino lliure (GlcNH3+). En condicions fisiològiques, els grups sulfat èster i amida perden protons i atrauen contraions carregats positivament per formar una sal d'heparina. És en aquesta forma que l'heparina se subministra normalment com a anticoagulant. Una unitat d'heparina (la "Unitat Howell") és una quantitat aproximadament equivalent a 0,002 mg d'heparina pura, que és la quantitat requerida per guardar i mantenir 1mL de fluid de sang de gat durant 24 hores a 0 °C.[7]
Abreviacions
Estructura tridimensionalL'estructura tridimensional de l'heparina és complicada pel fet que l'àcid idurònic pot estar present en qualsevol de les dues conformacions de baixa energia quan està col·locat internament dins d'un oligosacàrid. L'equilibri conformacional és influenciat per l'estat de sulfatació adjacent de la glucosamina.[8] Això no obstant, l'estructura de solució de l'heparina dodesacàrida composta només per sis GlcNS(6S)-IdoA(2S) unitats repetides ha estat determinada utilitzant una combinació d'espectroscòpia NMR i tècniques de modelatge molecular.[9] Dos models van ser construïts, un en el qual tot el IdoA(2S) estava en la conformació 2S0 (A i B a sota), i una en el qual estan en la conformació 1C4 (C i D a sota). Tot i així no hi ha cap prova que suggereixi que els canvis entre aquestes conformacions ocorren d'una manera concertada. Aquests models corresponen al codi del banc de dades de proteïna 1HPN.  A la imatge de sobre:
En aquests models, l'heparina adopta una conformació helicoidal, la rotació dels grups sulfat s'agrupa a intervals regulars d'aproximadament 17 àngstroms (1,7 nm) en qualsevol costat de l'hèlix helicoidal. Ús mèdicL'heparina és un anticoagulant natural produït per basòfils i mastòcits.[10] L'heparina actua com a anticoagulant, prevenint la formació de coàguls i l'extensió dels coàguls existents per la sang. Mentre l'heparina no trenca els coàguls que ja s'han format (a diferència de l'activador del teixit plasminogen), deixa els mecanismes naturals de lisi de coàguls treballar normalment per descompondre els coàguls que encara no s'han format. L'heparina s'usa per a l'anticoagulació en les següents condicions:
L'heparina i els seus derivats (enoxaparina, dalteparina, tinzaparina) són efectius en la prevenció de trombosis de vena profunda i embòlies pulmonars en pacients en risc,[11][12] però no hi ha proves que un sigui més efectiu que un altre en la prevenció de la mort.[13] L'heparina s'uneix a l'enzim inhibidor antitrombina (AT) provocant un canvi conformacional que ocasiona la seva activació a través d'un increment de la flexibilitat del seu lloc reactiu del bucle.[14] Llavors, l'AT activada inactiva la trombina i altres proteases involucrades en la coagulació de la sang, més notablement el factor Xa. L'índex d'inactivació d'aquestes proteases per AT pot augmentar fins a 1000 vegades degut a la unió de l'heparina.[15] L'AT s'uneix a una seqüència específica pentasacàrida sulfatada continguda dins del polímer de l'heparina:
El canvi conformacional en l'AT en l'heparina vinculada intervé en la seva inhibició del factor Xa. Per la inhibició de la trombina, tot i així, la trombina ha d'unir-se també al polímer de l'heparina a un lloc proper al pentasacàrid. La densitat de càrrega altament negativa de l'heparina contribueix a la seva forta interacció electroestàtica amb la trombina. La formació d'un complex ternari entre l'AT, la trombina i l'heparina resulta de la inactivació de la trombina. Per aquesta raó l'activitat de l'heparina contra la trombina depèn de la mida, exigint que el complex ternari tingui com a mínim 18 unitats de sacàrid per a una formació eficient.[16] En canvi, l'activitat de l'antifactor Xa només requereix el lloc d'unió del pentasacàrid.  Aquesta diferència de mida ha portat al desenvolupament d'heparines de baix pes molecular (LMWHs) i més recentment al fondaparinux com a anticoagulants farmacèutics. L'heparina de baix pes molecular i el fondaparinux apunten més a l'activitat de l'antifactor Xa que a l'activitat de l'antitrombina (IIa), amb el propòsit de facilitar una regulació més subtil de la coagulació i un índex terapèutic millorat. L'estructura química del fondaparinux es mostra a l'esquerra. És un pentasacàrid sintètic, l'estructura química del qual és gairebé idèntica a la seqüència del AT unit al pentasacàrid que pot ser trobat dins de i l'heparina polimèrica i l'heparan sulfat. Amb l'heparina de baix pes molecular i el fondaparinux, hi ha un risc menor d'osteoporosi i de trombocitopènia induïda per heparina (HIT). Controlant l'APTT tampoc es requereix i en efecte no reflecteix l'efecte de l'anticoagulant, com que l'APTT és insensible a alteracions en el factor Xa. El danaparoide, una mescla d'heparan sulfat, dermatan sulfat i condroitín sulfat, pot ser utilitzat com a anticoagulant en pacients que han desenvolupat el HIT. Perquè el deparanoide no conté heparina o fragments d'heparina, la reactivitat del danaparoide amb anticossos induïts per heparina es presenta menys d'un 10%.[17] Els efectes de l'heparina són mesurats al laboratori pel temps parcial de tromboplastina (aPTT), (el temps que triga el plasma sanguini a coagular-se). AdministracióEls detalls de l'administració estan disponibles en les guies de pràctiques clíniques per l'American College of Chest Physicians:[18]
La dosi d'heparina pot ser gestionada efectivament utilitzant tècniques com el Sonoclot. L'heparina es dona parenteralment, ja que es degrada quan es pren per la boca. Pot ser injectada per via intravenosa o subcutània (sota la pell). Les injeccions intramusculars (dins del múscul) s'eviten perquè es poden formar hematomes. A causa de la seva curta mitjana de vida biològica d'aproximadament una hora, l'heparina s'ha de donar freqüentment o com una infusió contínua. Tot i així, l'ús de l'heparina de baix pes molecular (LMWH) ha permès una dosi d'un cop al dia, no requerint una infusió contínua del medicament. Si es requereix un termini llarg d'anticoagulació, l'heparina normalment s'utilitza només per començar la teràpia d'anticoagulació fins que l'anticoagulant oral warfarina fa efecte. Efectes adversosUn efecte secundari seriós és la trombocitopènia induïda per heparina (HIT). La HIT és causada per una reacció immunològica que fa de les plaquetes un objectiu de la resposta immunitària, tenint com a resultat la degradació de plaquetes. Això és el que causa la trombocitopènia. Aquesta condició normalment s'inverteix amb la interrupció, i pot ser evitada amb l'ús d'heparines sintètiques. També hi ha una forma benigna de trombocitopènia associada amb l'ús anticipat de l'heparina, que es resol sense aturar l'heparina. Hi ha dos efectes secundaris no hemorràgics del tractament de l'heparina. El primer és l'elevació del nivell d'aminotransferases al sèrum, que han sigut recollits en un 80% dels pacients que rebien heparina. Aquesta anormalitat no està associada a la disfunció del fetge, i desapareix després de la interrupció del medicament. L'altra complicació és la hipercalièmia, que ocorre en un 5-10% dels pacients que prenen heparina, i és el resultat de la supressió d'aldosterona induïda per heparina. La hipercalièmia pot aparèixer pocs dies després de l'inici del tractament amb heparina. Alguns efectes secundaris estranys són l'alopècia i l'osteoporosi amb l'ús crònic. Com amb molts medicaments, les sobredosis d'heparina poden ser fatals. Al setembre del 2006, l'heparina va rebre publicitat mundial quan tres nadons prematurs van morir després que se'ls administrés erròniament sobredosis d'heparina a l'hospital d'Indianapolis.[19] Tractament per sobredosiLa protamina sulfat (1 mg per 100 unitats d'heparina que han sigut administrada les últimes 4 hores) ha de fer administrada per contraatacar l'anticoagulant d'heparina.[20] HistòriaL'heparina és un dels medicaments més antics estès encara actualment en l'ús mèdic. El seu descobriment l'any 1916 precedeix l'establiment de l'Administració Aliment i Medicament dels EUA, encara que no va entrar en assajos clínics fins al 1935.[21] Al principi va ser aïllada de cèl·lules de fetge caní, d'aquí el seu nom (hepar o "ήπαρ" en grec és fetge). El descobriment de l'heparina pot atribuir-se a les activitats de recerca de dos homes, Jay McLean i William Henry Howell. El 1916, McLean, un estudiant de medicina de segon curs a la Universitat Johns Hopkins, estava treballant sota l'orientació de Howell investigant preparacions pro-coagulants, quan va aïllar un fosfatat anticoagulant de soluble en greixos. Va ser Howell qui va inventar el terme heparina per a aquest tipus d'anticoagulant soluble en greix el 1918. Al començament dels anys 20, Howell va aïllar un polisacàrid anticoagulant soluble en aigua, el qual també va ser anomenat heparina, tot i que era diferent de les preparacions de fostatat aïllades prèviament. És probable que el treball de McLean canviés el l'enfocament del grup de Howell per a la recerca d'anticoagulants, que eventualment dirigia el descobriment del polisacàrid. Als anys 30, diversos investigadors estaven investigant l'heparina. Erik Jorpes a l'Institut Karolinska va publicar la seva recerca en l'estructura de l'heparina el 1935,[22] que va fer possible per la companyia sueca Vitrum AB el llançament del primer producte d'heparina per ús intravenós el 1936. Entre els anys 1933 i 1936, els Connaught Medical Research Laboratories, en aquell moment part de la Universitat de Toronto, van perfeccionar una tècnica per produir heparina segura i no tòxica que va poder ser administrada a pacients en una solució de sal. Les primeres proves humanes de l'heparina van començar al maig del 1935, i pel 1937 estava clar que l'heparina de Connaught era segura, fàcilment disponible, i un anticoagulant de sang efectiu. Abans del 1933, l'heparina estava disponible, però en petites quantitats, i era extremadament cara, tòxica i, com a conseqüència, sense valor mèdic.[23] Per a una discussió completa dels fets que rodegen el descobriment de l'heparina, vegeu Marcum J. (2000).[24] Ara el líder fabricant de l'heparina és SPL, una companyia que pertany a Oscar Meyer. Noves oportunitats de desenvolupament de medicina per l'heparinaCom està detallat a la taula de sota, hi ha molt potencial pel desenvolupament d'estructures semblants a l'heparina com a medicaments per tractar una àmplia gamma de malalties, a més del seu ús corrent com a anticoagulants.[25][26]
Com a resultat de l'efecte de l'heparina en una gran varietat d'estats de malaltia, un nombre de medicaments s'estan desenvolupant amb una estructura molecular idèntica o similar a les trobades dins de parts de la cadena polimèrica de l'heparina.
Tècniques de despolimeritzacióLa despolimerització química o enzimàtica o una combinació de les dues sustenten una vasta majoria de les anàlisis dutes a terme sobre l'estructura i la funció de l'heparina i l'heparan sulfat (HS). EnzimàticaEls enzims tradicionalment utilitzats per digerir l'heparina o l'HS són produïts de manera natural pel bacteri de terra Pedobacter heparinus (antigament anomenat Flavobacterium heparinum).[27] Aquest bacteri és capaç d'utilitzar l'heparina i l'HS com la seva font de carboni i de nitrogen. Per tal de fer-ho, produeix una gamma d'enzims com liases, glucuronidases, sulfoesterases i sulfamidases.[28] Aquesta és la liasa que s'ha fet servir principalment pels estudis d'heparina i d'HS. El bacteri produeix tres liases, heparinases I (EC 4.2.2.7), II (sense EC number assignat) i III (EC 4.2.2.8) i cadascun té una especificitat pel substrat diferent com està detallat a sota.[29][30]
[[Fitxer::UA(2S)-GlcNS(6S).svg|miniatura|UA(2S)-GlcNS(6S(|enllaç=Special:FilePath/:UA(2S)-GlcNS(6S).svg]] Les liases trenquen l'heparina i el HS per un mecanisme de beta eliminació. Aquesta acció genera una doble unió insaturada entre el C4 i el C5 del residu uronat.[31][32] L'uronat C4-C5 insaturat s'anomena ΔUA o UA. És un cromòfor sensible als UV (absorció màxima a 232 nm) i permet un ritme de digestió d'un enzim per ser seguit a més de proporcionar un mètode convenient per detectar fragments produïts per la digestió enzimàtica. QuímicaL'àcid nítric es pot utilitzar la despolimerització química del l'heparina i l'HS. L'àcid nítric es pot ser fet servir a pH 1.5 a un pH més alt de 4. Sota les dues condicions, l'àcid nítric efectua la divisió deaminativa de la cadena.[33]  Al pH alt (4) i al pH baix (1.5), la divisió deaminativa ocorre entre GlcNS-GlcA i GlcNS-IdoA, tot i ser més lent en el pH més alt. La reacció de deaminació, i per tant la divisió de la cadena, no té en compte la O-sulfatació duta a terme per qualsevol de les unitats monosacàrides. A baix pH, de la divisió deaminativa en resulta l'alliberació de SO4 inorgànic, i la conversió de GlcNS a anhidromanosa (aMan). El tractament amb àcid nítric a baix pH és un mètode excel·lent per distingir els polisacàrids N-sulfatats com l'heparina i l'HS dels polisacàrids no N-sulfatats com el condroitín sulfat i el dermatan sulfat; el condroitín sulfat i el dermatan sulfat no sent susceptibles a la divisió de l'àcid nítric. Conservació evolutivaA més a més dels teixits bovins i porcins procedents de l'heparina farmacèutica comunament extreta, l'heparina també ha sigut extreta i caracteritzada de les següents espècies:
L'activitat biològica de l'heparina dins de les espècies 6-11 no és clara i dona suport a la idea que la funció principal de l'heparina no és l'anticoagulació. Aquestes espècies no tenen un sistema de coagulació de sang similar al que presenten les espècies 1-5. La llista de sobre també demostra com l'heparina ha estat conservada evolutivament amb molècules d'estructura similar produïdes per un ampli rang d'organismes pertanyents a diferents fílums. Altres usos/informació
ControvèrsiesRetirada del mercat per contaminacióAl desembre de 2007, la U.S Food and Drug Administration (FDA) va retirar del mercat un carregament d'heparina a causa del creixement de Serratia marcescens en diverses xeringues sense obrir d'aquest producte. El bacteri Serratia marcescens pot conduir a lesions amb risc vital i/o la mort.[51] El març de 2008, la major retirada del mercat d'heparina va ser anunciada per la FDA degut a la contaminació de l'assortiment d'heparina sense refinar importada de la Xina.[52][53] D'acord amb la FDA, l'heparina contaminada va matar 81 persones als Estats Units. El contaminant va ser identificat com un "sobre-sulfatat" derivatiu del condroitín sulfat, un popular suplement derivat del marisc normalment utilitzat per l'artritis.[54] Ús en homicidisEl 2006, Petr Zelenka, un infermer de la República Txeca, va administrar deliberadament grans quantitats als pacients, matant-ne 7 i intentant matar-ne 10 més.[55] Problemes per sobredosiEl 2007, un infermer al Cedars-Sinai Medical Center va donar per error als bessons de 12 dies d'edat de l'actor Dennis Quaid una dosi d'heparina que superava 1000 cops la dosi recomanada per als infants.[56] La sobredosi es va produir suposadament perquè l'etiqueta i el disseny de les versions del producte per als adults i els infants eren semblants. La família Quaid posteriorment va demandar el fabricant, Baxter Healthcare Corp.,[57][58] i va arreglar comptes amb l'hospital per 750.000 $.[59] Abans de l'accident de Quaid, sis nounats al Methodist Hospital a Indianapolis (Indiana) se'ls havia administrat una sobredosi. Tres dels nadons van morir després de l'error.[60] Al juliol de 2008, una altra parella de bessons nascuts al Christus Spohn Hospital South, un hospital ubicat al Corpus Christi (Texas), van morir després de l'administració d'una sobredosi accidental del medicament. La sobredosi va ser a causa d'un error de mescla a la farmàcia de l'hospital i no estava relacionat amb l'empaquetatge o etiquetatge del producte.[61] Des del juliol e 2008, si les morts van ser degudes a una sobredosi està sota investigació.[62][63] Vegeu tambéReferències
Enllaços externs |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||