|
Ikatan pi Dalam kimia, ikatan pi (ikatan π) adalah ikatan kimia kovalen yang dua cuping orbital atom yang berlektron tunggal bertumpang tindih dengan dua cuping orbital atom lainnya yang juga berlektron tunggal. Hanya terdapat satu bidang simpul dari orbital yang melewati dua inti atom. 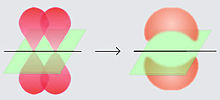 Huruf Yunani π berasal dari nama orbital p karena simetri orbital ikatan pi adalah sama dengan orbital p ketika dilihat dari sumbu ikatan. Orbital p biasanya terlibat dalam ikatan sejenis ini. Orbital d juga dianggap terlibat dalam ikatan pi, tetapi tidaklah seperlunya benar, walaupun konsep ikatan orbital d sesuai dengan hipervalensi. Ikatan pi biasanya lebih lemah dari ikatan sigma karena rapatan elektronnya lebih jauh dari inti atom yang bermuatan positif, sehingga memerlukan lebih banyak energi. Dari sudut pandang mekanika kuantum, kelemahan ikatan ini dijelaskan oleh ketumpangtindihan yang sangat sedikit di antara orbital p oleh karena orientasinya yang paralel. Walaupun ikatan pi lebih lemah dari ikatan sigma, ikatan pi sering kali merupakan komponen dari ikatan rangkap bersamaan dengan ikatan sigma. Kombinasi dari ikatan sigma dan pi lebih kuat dari ikatan pi dan sigma yang berdiri sendiri. Kekuatan ikatan yang bertambah dari ikatan rangkap diindikasikan oleh banyak pengamatan, tetapi yang paling menonjol adalah kontraksi panjang ikatan. Sebagai contoh, dalam kimia organik, panjang ikat karbon-karbon pada etana adalah 154 pm, etilena 133 pm, dan asetilena 120 pm. 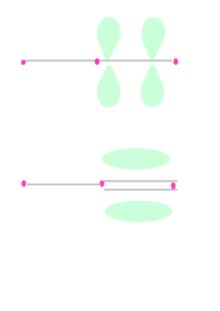  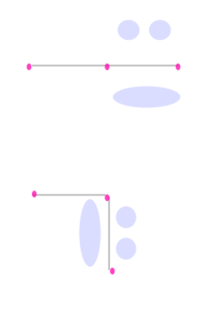 Selain ikatan sigma, sebuah pasangan atom yang dihubungkan dengan ikatan rangkap dua memiliki satu ikatan pi dan ikatan rangkap tiga memiliki dua ikatan pi. Ikatan pi dihasilkan dari tumpang tindih orbital-orbital. Ikatan pi memiliki sifat yang lebih baur dari ikatan sigma. Elektron-elektron pada ikatan pi kadang kala dirujuk sebagai elektron pi. Fragmen molekul yang dihubungkan dengan ikatan pi tidak dapat diputar tanpa memutuskan ikatan pi tersebut, karena perputaran akan merusak orientasi paralel dari orbital-orbital p yang membentuk ikatan pi. Kasus khususIkatan pi tidak seperlunya menghubungkan sepasang atom yang juga memiliki ikatan sigma. Pada beberapa kompleks logam, interaksi pi antara atom logam dengan orbital antiikat pi alkana dan alkena membentuk ikatan pi. Dalam beberapa kasus ikatan rangkap banyak antara dua atom, tidak terdapat ikatan sigma sama sekali, yang ada hanyalah ikatan pi. Contohnya meliputi diferri heksakarbonil (Fe2(CO)6), dikarbon (C2) dan borana B2H2. Dalam senyawa-senyawa ini, ikatan pusat hanya terdiri dari ikatan pi, dan agar mencapai wilayah tumpang tindih yang maksimum, panjang ikatan menjadi lebih pendek dari yang diperkirakan.[1] Lihat pulaReferensi
|